Japan Quantitative Imaging Biomarker Alliance (J-QIBA)
Quantitative Imaging Biomarker
Amyloid-PET
QIBA Profile. 18F-labeled PET tracers targeting
Amyloid as an Imaging Biomarker
Version PUBLIC COMMENT
15 June 2017
目次
1.エグゼクティブサマリー
臨床試験用途の概要
2.臨床状況とクレーム
臨床試験のためのユーティリティーとエンドポイント
クレーム
3.プロフィールアクティビティ
3.1.件名の処理
3.2.画像データの取得
3.3.画像データの復元と後処理
3.4.画像解析
3.5.イメージの解釈と報告
3.6.品質管理
4.適合手順
4.1.パフォーマンスアセスメント:画像取得サイト
4.2.性能評価:PET取得デバイス
4.3.パフォーマンスアセスメント:復元フトウェア
4.4.パフォーマンスアセスメント:イメージ分析ワークステーション
4.5.パフォーマンスアセスメント:ソフトウェアバージョンのトラッキング
参考文献
付録
付録A:謝辞とアトリビューション
付録B:クレームの背景情報
付録C:規約と定義
付録D:モデル固有の命令とパラメーター
付録E:共通データフォーマットメカニズムに記録されるデータフィールド
付録F:FDG-PET / CTデジタル参照オブジェクトを使用したPET / CTディスプレイおよび解析システムのテスト
付録G:ホフマン脳のファントムのベストプラクティスガイダンス
付録H:ホフマン ファントム データ分析の詳細な例
ファントム説明
方法とメトリック
方法の概要
関連データファイル
方法の詳細 - 処理ステップ
ADNI Hoffmanの適性データを使用した結果例
未解決問題:
以下の未解決諸問題が提起されました。
関連する議論を取り上げるため、またフィードバックを必要とするトピックに査読者の注意を集中させるため、そして究極的に諸問題を解決するべく諸問題を追跡するために、これらの諸問題が提起されています。
パブリックコメントの段階で、これらの諸問題に関するコメントが強く求められています。
| クレーム・コンテキスト アミロイド沈着のみの差異とは無関係の生物学的変化によって大方(時間経過中の8%以上SUVRの変化)が説明される関心事項を提供する可能性および方法。 |
| 適合方法論 画像解析ワークステーションの適合性試験を実施するための方法論が含まれています。これはDRO(Digital Reference Object)を使用する事に依存しています。(DROはNIBIBの基礎プロジェクトとして資金提供されており、現在進行中の作業です。) |
| 部位別の諸要件 ラジオトレーサーに依存している場合としていない場合の時間経過の中で、解剖領域分類に関する諸要件(例えばMRI-PET融合といった被検者の解剖学特異性、もしくはアトラスに基づくものかどうか)をどのように定義するか。 |
| コンフォーマンス試験 施行者が以下3点を試験するため、実施すべきスタディを記述する必要があります。 1. wCVが0.029未満であること 2. wCVがSUVRの範囲で一定であること 3.1つの傾きの直線性が合理的な想定範囲内にあること |
| 参考文献 参考文献は未完成です。これらはパブリックコメントの段階で完成すると思われます。 |
1.エグゼクティブサマリー
このQIBAプロファイルは、神経学領域でのアミロイドを標的とした18F標識トレーサーの使用からスキャンにおよぶPETイメージングの利用についての同等性および一貫性を規定する仕様および要件について記載しています。この文書は主にPET / CTイメージングについて記載しています。 また、伝送能力を有する専用PETにも使用することができます。PET / CTおよび専用PETスキャナーと比較して、PET / MRスキャナーは新規性と未知の定量化の違いから、このバージョンでは除外されています。臨床試験および個々の患者管理の双方にこのプロファイルガイダンスを適用することができます。
この文書は、取得、再構築、後処理、分析、解釈について記載しており、これらはデータを情報および知識に変換する際のパイプライン上の段階に該当します。
QIBA核医学技術小委員会のアミロイドプロファイル ライティング グループにより作成されたこの文書は、アミロイドトレーサーPETデータの取得および分析に使用される装置に焦点を当てた追加資料だけでなく、QIBA FDG-PETプロファイルにも共有されています。
F18アミロイドPET脳イメージングのQIBAプロファイル
| Part1 エグゼクティブサマリー |
| Part2 臨床的背景と要求 |
| Part3 プロファイルアクティビティ |
| Part4 コンプライアンス手順 |
図1 プロファイルコンポーネントの図
プロファイルPart 3は、アルツハイマー病神経イメージングイニシアチブ(ADNI)の作業資料を含め、複数の情報を基に作成されています。アミロイドトレーサーがアミロイド陽性被験者を主に選択する際に使用される横断的要求にとって、高レベル画像測定精度が最も重要な要求となる可能性があります。現在のプロファイルは縦断的要求について記載されており、その主目的は介入後のアミロイド蓄積変化を評価することです。バイアスが常に存在し続ける限り、バイアスよりも精度がより重要となる場合があります。
臨床試験用途の要約
QIBAアミロイド-PETプロファイルは、単施設および多施設で行われる神経疾患、主に認知症の臨床試験において使用される脳アミロイドトレーサーPETスキャンの技術的および行動的なパフォーマンスレベルおよび品質管理仕様を定義しています。正確性のための具体的な要求は、以下の要求に詳述されています。
QIBAプロファイル仕様の目的は、調査における介入以外の要因による、被験者内および被験者間、プラットフォーム内およびプラットフォーム間、施設間での定量的スキャンデータの変動を最小限に抑えることです。このQIBAプロファイルの技術仕様に従って実施されるアミロイドトレーサーを用いたPET研究は、複数時点での比較評価のための定性的および/または定量的データを提供します(例:治療反応評価、治療有効性の予測および予後のバイオマーカー調査)。プロファイルの詳細は、単一時点での被験者の評価にも適用されますが、現在はこのプロファイルに横断的な要求は含まれていません。
典型的なPETスキャナー測定システム(全ての支持装置を含む)は数日または数週間にわたり安定性を保てますが、臨床試験を完了するまでの全期間にわたり、この安定性を維持し続けることはできない事が、このプロファイル作成の動機となっています。また、異なる画像施設では同タイプのスキャナーを使用してもスキャナーおよび操作に違いがみられます。
この文書の対象者は次のとおりです。
- この目的のために製品を作成するソフトウェアおよびデバイスメーカーの技術スタッフ。
- 試験の画像エンドポイントを計画するバイオ医薬品企業、神経科医、および臨床試験科学者
- 臨床研究の専門家。
- 新しいPET / CT機器(または後続の文書バージョンではPET / MR)調達に関する仕様を検討している医療機関の放射線科医、核医学の医師、技師、物理士および管理者。
- PET / CT(およびPET / MR)取得プロトコールを設計する放射線科医、核医学の医師、技師、および物理士。
- PET画像から定量的な測定を行う放射線科医、核医学科医師、および他の医師または物理士。
- 定量的画像測定に基づいて決定を下す調整者、核医学科医師、神経内科医、その他の者。
この文書で「要件」と記載されている仕様は、要求を達成するための要件にすぎず、「ケアの基準要件」ではないことに注意してください。 具体的には、患者を適切にケアすることが一番重要であり、このプロファイル目標を達成することは、患者の適切なケアに対して二の次となります。
2.臨床的状況と要求
アミロイド斑を形成するアミロイド-B(AB)線維の蓄積は、アルツハイマー病(AD)による認知症の病理学的診断における神経病理学的要件です。 ABを評価するために開発中の様々なバイオマーカーの中で、18F PETアミロイドトレーサーは、皮質AB沈着を直接検出し定量化できる可能性があります(現在承認されているアミロイド沈着の質的評価のための放射性トレーサー3.1.3.1.2項の表を参照してください)。アミロイド沈着のない正常な対照被験者と比較して、ADおよびADに起因する軽度認知障害(MCI)を有する個人では典型的には皮質AB沈着が増加していることが、神経学において放射性トレーサーを使用する理論的根拠となっています。
臨床有益性にとっての有益性とエンドポイント
PETを用いたB-アミロイド(AB)イメージングは、脳におけるAB沈着のin vivo評価を可能にします。
このQIBAプロファイルは、被験者の脳アミロイド蓄積変化を継時的に評価し、疾患状態や治療薬を評価する目的で使用されるイメージングバイオマーカーとしてPETを用いた18 F-アミロイドトレーサー集積の測定要件について記載しています。ある一時点(横断的またはバイアス要求)におけるアミロイド沈着の定量的評価は、現在のプロファイルでは記載されていません。
患者層別化または治療反応評価を目的とした臨床研究において有用であったバイオマーカーは、アミロイド-PETによって定量化された反応の程度に基づいて、臨床での治療薬の第一選択やさらには治療レジメンの個別化に有用となる可能性があります。
このプロファイルに記載されている技術仕様は、被験者内の縦断的変化の測定に適用されます。アミロイドPETプロファイルの一部は、FDG-PETプロファイルから引用されており、一般に他のトレーサーおよび別の適用とした他のアプリケーション内の定量的PETイメージングにも適用可能です。
陰性アミロイドPETスキャンは、神経性プラークがまったくないことを示し、陽性アミロイドスキャンは、中程度から高度のアミロイド神経炎プラークを示しています。
要求
プロファイル基準が満たされている場合:
要求1:SUVRによって反映される脳アミロイド沈着は、2.9%以内の対象内変動係数で18FアミロイドトレーサーPETから測定可能です。
要求2:Δ%のSUVR変化が測定された場合は、Δ> 8%で95%信頼区間で真の変化が生じたことを示します。
要求3:Y1とY2が2つの時点におけるSUVR測定値である場合、真の変化の95%信頼区間は(Y2-Y1)±1.96×√([Y1×0.029] ^ 2 + [Y2×0.029 ] ^ 2)となります。
このプロファイルの要求は、その土台となる役割として実施されたメタ分析を含む文献の広範なレビュー(付録B参照)によって周知されてきました。ただし、この文書の仕様に厳密に準拠した研究によって実証されていない合意要求なのが現状です。これまでの文献報告では、蓄積率が年平均1%から数%と報告されているため、要求に記載されている閾値変化基準(8%)というのは、生物学的変化や治療介入による生物学的変化の改善評価に実用的あるいは適切ではない可能性を委員会は認識しています。閾値を決定するために使われ、また参照された基準試験 - 再試験調査は、60日間以下の期間に限定されています。しかし、これらの研究には、このプロファイルで推奨されるバラツキを制限するアプローチが必ずしも組み込まれてはいません。
つい最近公開された、もしくは未公開の研究によると、参照領域などの因子が最適化された場合には許容誤差が厳しくなることが示唆されていますが、それらの試験は60日間以下の試験―再試験の期間基準を満たしていませんでした。これらの制限がありますが、委員会の見解としては、この文書に記載されている性能要件を共有することにより、臨床試験および臨床診療の両方においてアミロイドイメージングを使用する専門家のコミュニティが要求閾値を精緻化することで、より確実なデータを取得することが可能になるとしています。
次の重要な検討事項が記載されています。
- この要求はPETで評価可能と判断された被験者のスキャンにのみ適用されます。実際には、スキャンが十分に診断可能な品質であり、標的組織ROIおよび参照組織ROIが適切に評価できる分析要件で実施されることを意味します。評価可能である被験者スキャンついての詳細は第3.6.5.3項で説明しています。
- 要求詳細は文献レビューに基づいていたものであり、付属文書Bに要約されています。これらの報告にはSUVRの再現性について記述されるであろうと想定されていました。
- この要求は、同じスキャナモデル(およびリリース)を使用する単一施設の研究に適用されます。多施設研究の場合では、18 F-アミロイドトレーサーPETイメージングが(プロファイルに記載されている)各時点で各被験者に対して同じスキャナーおよびプロトコールを用いて実施される場合に、この要求が達成されると予想されています。
- この縦断的要求項では、SUVR変化率は、[(時間点2のSUVR - 時間点1のSUVR)/時間点1のSUVR]×100として定義されます。
- 要求項1の統計的測定基準は再現性係数(RC)であり、請求項2の統計的測定基準は被験者内変動係数です。
- 両者の要求項について、a)wCVはSUVR値の範囲にわたって一定であり、b)測定値におけるバイアスはSUVR値(直線性)の範囲にわたって一定であると推定されます。
- このプロファイルでは、SUVRは参照領域の画素数またはSUVmeanを使用して測定されます。SUVRは単に対象と基準の比を表すので、SUVR計算の前に再構成された画像をSUV画像に変換する必要はありません(図3を参照)。 SUVは注射後の所定の集積時間間隔での放射性トレーサー集積を表す単純化された測定基準です。SUVは血液中(典型的には組織の3〜8%が血液量になります)や、遊離トレーサー、非特異的および/または非選択的に組織に結合したトレーサー、そして特定の標的、本件ではアミロイドに特異的に結合したトレーサーからなる複合シグナルです。(Gunn RN et al. JCBFM. 2001 Jun;21(6):635-52, Innis et al, JCBFM. 2007 Sep;27(9):1533-9, Schmidt KC1, Turkheimer FE, Q J Nucl Med. 2002 Mar;46(1):70-85.)。SUVを基準領域のものに標準化することで、組織中の遊離および非特異的に結合したトレーサーからのシグナルを相殺または補正し、単純化された分布容積比(DVR)の基準が求められます。 しかしながら、種々の組織から生じる絶対的なシグナルおよび相対的なシグナルは、灌流や脳内の非特異的および特異的結合の違いによる集積時間に依存します。 特に、灌流はトレーサーの流入(送達)を決定するだけでなく、トレーサーの洗い流し(ウォッシュアウト)も決定することに留意すべきです。 さらに、洗い流しは非特異的および特異的結合の相対的寄与によっても影響をうけます。すなわち、より多くの「結合がウォッシュアウトを遅く」します。 また、後者はDVRと比較してSUVRにみられる上方バイアスを説明しています(van Berckel et al, J Nucl Med. 2013 188
Sep;54(9):1570-6)。単純化された参照組織モデル(およびSUVR)を使用する場合の様々なバイアス源に関する詳細な議論は、(Salinas et al. JCBFM Feb;35(2):304-11, 2015)に記載されています。放射性トレーサーの基本的な運動特性から、SUVとSUVR(DVRの代用品として)の両者は灌流依存性であり、脳全体および縦断的な灌流の変化がSUVRの変化をもたらすことが理解されます。その結果、SUVR変化は、特異的なシグナル(アミロイド)の変化だけを表すのではなく、少なくとも部分的には灌流(van Berckel et al, J Nucl Med. 2013 Sep;54(9):1570-6)や組織クリアランス(Carson RE、Channing MA、Blasberg RG、Dunn BB、Cohen RM、Rice KC、Herscovitch P. 受容体定量のためのボーラスおよび注入法の比較:[18F]陽電子放出断層撮影法(J Cereb Blood Flow Metab。1993 Jan; 13(1):24-42)の変化または変動の結果である可能性もあります。SUVRの変化がアミロイドおよび/または灌流の変化によって影響を受けるかどうかは、大規模臨床試験でSUVRが使用される前に小コホートで最初に実証されるべきです。少なくとも、(疾患および/または薬物に関連する)灌流効果により生じる偽陽性所見を除外するために必要とされる最小限必要のSUVR減少を評価するため、これらの検証研究は実施される必要性があります。
さらに、この要求はPSF(point spread function)による再構成やTOF(タイムオブフライト)イメージングなどの、公開済みの試験-再試験研究では利用されなかった技術変化についても再評価される必要性があります。十分な数の研究により活用されている標準は、現在のところ存在していません。今後の調査やフィールドテストで、データが収集され、その結果、この要求またはプロファイル仕様に変更が加えられるでしょう。
3.プロファイル活動
以下の図は、技術レベルでのマーカーについて図解しています。
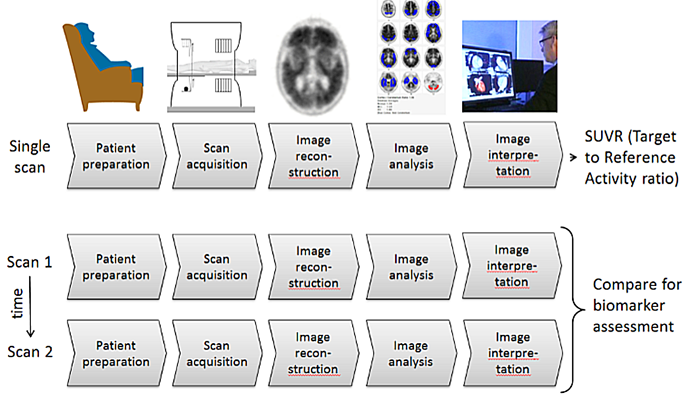
図3:PETを使用して脳アミロイド集積を計算し解釈する方法は、1つのスキャン(将来の「横断」要求の使用のための適合に相当する)または2つ以上のスキャンシーケンスまたは時点(現在のプロファイルの「縦方向」要求の使用に対する適合度に対応します)のいずれかを使用する一連のステップとして見ることができます。得られたスキャンについて、SUVRは参照領域(典型的には小脳(全体または灰白質)または橋ですが、他の領域を含む可能性があります)との活性を比較した特定の脳領域の集積を示します(セクション4.4を参照)。これらの異なる領域(標的/参照)から集積比が計算され、これがSUVRと呼ばれます。
さらに、このプロファイルの画像解析セクションで議論されているように、さらなる調査が行われれば、センチロイドスケールにより、基準に対してマッピングされ(例えば、線形スケーリングプロセスや平均値の使用など)、ある程度まで(今後定義される)同等化された異なるアミロイドPETトレーサーを用いた研究を可能とするメカニズムを提供してくれる可能性があります。[3.4.3.3.3項参照])。現時点ではセンチロイド方法論の検証は保留中であり、複数施設を介したデータ集積を前提として、このプロファイルは多施設試験での単一放射性トレーサーの使用を要求しています。
様々な機序を介してアミロイド-PETイメージングのために、患者が選択または参照されるかもしれません。
図1に対応する撮像手順は、
- 患者または被験者のスキャン準備を行い、アミロイドトレーサーを投与します。 患者は、生体への分布とアミロイドトレーサー集積まで待機します。リガンド特異性のタイミングについては、セクション3.1.3.1.2を参照してください。
- 放出データおよび送信データを取得します(通常、PET-CTスキャナーの場合はPETスキャンおよびCTスキャンとなります)。
- データ補正項が推定され、減衰および散乱補正画像が再構成されます。
- 定性的解釈のため、画像が評価されます。
- 定量的(および/または半定量的)測定が行われます。
各トレーサーの添付文書に記載されている仕様を参照したレビュー内容(臨床研究と臨床業務)に応じて、ステップ4および5はどちらかの順序で、または同時に行うことができます。現在、臨床業務におけるアミロイド-PETトレーサーの定量的使用は、いかなる規制機関によっても承認されていません。より詳細な要件については以下に記載されています。
画像は単一あるいは数か月~数年間の複数時点で取得されます。例えば、治療反応評価の治療前後といった最低2時点で画像が取得されます。
以下のセクションでは、図3に示す主要な項目について説明します。
| セクション | タイトル | アクター |
| 3.1 | 件名の取り扱い | イメージ取得施設の職員(技術者とスケジューラを含む) |
| 3.2 | 画像データ収集 | 画像収集装置を用いた画像収集施設の技術者 |
| 3.3 | 画像データ再構成 | 再構成ソフトウェアを使用する画像収集施設の技術者 |
| 3.4 | 画像分析 | 再構成ソフトウェアを使用する画像収集施設の技術者 |
| 3.5 | 画像の解釈 | 再構成ソフトウェアを使用する画像収集施設の技術者 |
画像データの収集、再構成、および後処理は、被検者からの新しいデータ収集および構造化を打ち出すものと見なされています。画像解析は主にデータを情報に変換し、重要な価値を引き出す計算手順とされています。主に解釈とは、情報を知識に変換する判断であるとみなされています。
3.1. 被験者の取り扱い
このプロファイルは主に「被験者」について言及し、患者への適用が一般的には推奨されますが、被験者とはしばしば患者でもあることをご留意ください。
3.1.1対象の選択とタイミング
相関的な解剖学的脳画像であるCTまたはMRIの有用性は、異なる2つの状況で見ることができます。臨床的観点からは、解剖学的画像研究は出血、感染、梗塞、または他病巣の証拠を評価するために使用されます(例えば認知症患者の評価では、記憶にかかわる重要部位のラクナ梗塞を同定することが重要となる場合があります)。
定量的アミロイドPET画像の性能要件を確立する観点から、(減衰補正マップを提供する有用性とは別に)解剖学的画像の目的は、結果として皮質萎縮と誤って減弱してしまったSUVRを評価することです。また、画像解析者は、頭蓋内出血などによる血液脳関門(BBB)の崩壊によりSUVRが誤って増加する可能性も考慮する必要があります。現時点ではBBB構造の違いによる効果は科学文献では定量化されていません。解剖学的画像の性能はプロファイルの性能要件ではありませんが、そのような画像撮影を実施し、その画像分析をアミロイドPET所見に組み込む価値は、個々の被験者の解釈に付加価値を提供する可能性があります。これは、試験プロトコールの設計および実施時に考慮される必要性があります。
適切な画像が得られない状態の被験者(被験者の鎮静に関する情報についてはセクション3.1.2.3を参照)の除外(絶対禁忌または相対禁忌)は別として、アミロイドPET画像の被験者選択は、このプロファイルの範囲外の問題です。アミロイドPETの適切な使用基準:アミロイドイメージングタスクフォース、核医学および分子イメージング学会、アルツハイマー病協会および患者の選択に関する詳細はメーカーガイドを参照してください。
3.1.1.1.介入活動に関する画像検査のタイミング
研究プロトコールは、(1)指標介入(例えば、アミロイド低減治療剤による治療)および(2)他の介入(例えば、事前処理)の両者とアミロイドトレーサーPETスキャンの性能を分離する時間間隔を明確に定める必要があります。この初回スキャン(または時点)は「ベースライン」スキャン(または時点)と呼ばれます。 ベースラインスキャンと治療開始時との時間間隔、ならびにその後のアミロイドPET研究と治療サイクルとの時間間隔を定める必要があります。さらに、研究プロトコールは画像化が特定される各時点(すなわち、画像化が「スケジュール通りに」得られる許容時間枠)ごとに、アミロイドPETスキャンを取得するための許容可能なタイミング変動を具体的に定義しなければなりません。
3.1.1.2. 交絡活動に関わるタイミング
スキャン開始前に避けるべきアミロイドトレーサーPET研究の偽陽性および/または偽陰性の可能性を増大させる活動、試験または介入などは特定されていません。
3.1.1.3. 補助的なテストに関わるタイミング
種々の神経精神医学的検査はアミロイドトレーサー画像検索を行う日、またはその近日中に行えるようにスケジュール調整する必要があります。
3.1.2 被験者の準備
被験者管理は、(1)画像検査前(到着前および到着時)、(2)画像検査中、(3)画像検査終了後の3つセッションから成る、異なる時間間隔の観点から考えることができます。画像検査前のセッションの問題は、このセクションに含まれていますが、画像検査中の問題は、画像データ取得について記載されているセクション3.2.1に含まれています。
3.1.2.1. 到着前
食事や飲水の必要や禁止はありません。
これらのパラメーターに関する適合性の問題は、画像取得施設のスケジューラーまたは技師が被験者と十分なコミュニケーションと監督を行えるかに左右されます。被験者とのコミュニケーションと適合性の確認は文書化される必要があります。
3.1.2.2. 到着時
到着時に被験者の手順前指示の順守確認を適切な症例報告書に文書化し、行わなければなければなりません。
3.1.2.3. 試験の準備
臨床試験の実施中は、全施設および被験者において、到着後および撮像前の被験者の準備は標準化される必要があります。
- 測定値SUVRはSUV比率で定義されるため、被験者の体重(および身長)の測定および記録は推奨されますが、このプロファイルの要件ではありません。
- 待機および準備室は、全集積期間を通してリラックスできる暖かい(> 75°Fまたは22°C)状態でなければなりません(注射前に合理的に実施できる限り、少なくとも15分は許容されます)。必要に応じてブランケットを用意する必要があります。
- 被験者は横たわったままであるか、快適に座っていなければなりません。
- アミロイドトレーサー注射後、被験者はトイレを使用する場合があります。検査のPET画像取得時の直前(5〜10分以内に)に被験者は排泄するのが好ましいとされます。
- 鎮静は日常的に必要ではありません。鎮静作用がアミロイドトレーサーの摂取を妨げるかどうかは不明です。前臨床試験の中には相互作用の可能性が示されていますが、すべてのトレーサーについて検証されたわけではありません。鎮静剤を使用するか否かの決定は、このプロファイルの範囲を超えており、禁忌のある特定被験者の臨床評価、および特定のトレーサーが鎮静剤との相互作用を受けるかどうかの知識が必要となります。これらの相互作用は完全に定義されていないので、(鎮静の有無にかかわらず)被験者の準備は、被験者のどの時点においても一定であるべきです。
- 液体摂取量およびすべての薬物(例えば利尿薬、鎮静薬)の使用は、適切な症例報告書に文書化されなければなりません。
- 被験者は財布や鍵などのかさばる持ち物をポケットから取り除かなければなりません。さらに、メガネ、イヤリング、ヘアクリップ/コーム(頭部がヘッドホルダーに置かれている間に不快感を引き起こす可能性のあるものすべて)があれば取り除く必要があります。スキャン中に静止するため、指示を守る(必要ならば聞く)ことが重要ですが、可能であればスキャナー内では補聴器も取り外すべきです。
3.1.3. イメージング関連物質の準備と管理
3.1.3.1. 放射性トレーサーの準備と投与
3.1.3.1.1. 放射性トレーサーの説明と目的
投与される特定のアミロイド放射性トレーサーは、高品質・高純度でなければなりません。例えば、アミロイドを標的とする放射性医薬品は、FDA、EU、欧州薬局方または他の適切な国内規制機関によって指定されているCGMP(Current Good Manufacturing Practice)に基づいて製造されなければなりません。21CFR212またはUSP <823>などの陽電子放出断層撮影のための放射性医薬品の米国規則は、米国または米国規制局に提出された試験に従わなければなりません。この文書の範囲を超えていますが、新しいアミロイドトレーサーについては、検証なしでSUVRがアミロイド沈着を反映するとは想定されていません。すなわち、SUVRがBPNDと線形関係にあることを確認するため、初回にfull kinetic analysisを実施する必要があります。
3.1.3.1.2. 放射性トレーサー活性の計算および/またはスケジュール
投与されたラジオトレーサー活性を求めるアミロイドは、利用される特定のトレーサーに依存します(以下の表を参照)。典型的には、用量は約185〜370MBq(5〜10mCi)の範囲となりますが、規制当局が承認したトレーサーの場合は、添付文書に従ってください。投与された活性は、典型的には局所イメージングプロトコールに依存します。 ローカルプロトコールでは固定化された活性が要求されるかもしれませんし、または被験者のサイズ、年齢または撮像方法を含むこれらに限定されない様々なパラメーターの作用として、活性が変化する可能性があります。正確な活性および活性の較正時間を記録する必要があります。チューブ、シリンジ、または自動投与システムに残っている残留活性、または注射中にこぼれた活性を記録する必要があります。被験者に注入された放射性トレーサーの純粋量を記録し、純粋なSUV計算のため正確な要因を提供することが目的です。
| パラメーター | フロルベタピル (アミヴィッド) [1] |
フルテメタモール (ビザミル) [2] |
フロルベタベン (Neuraceq) [3] |
NAV4694 |
| トレーサー 投与活性 |
370 MBq 最大質量線量 50 mcg |
185 MBq 最大質量線量 20 mcg |
300 MBq 最大質量線量 30 mcg |
300 MBq |
| パラメーター | エンティティ/アクター | 仕様 |
| 投与されたアミロイド放射性トレーサー活性 | 画像検査技師 | 技師は 1. 注入前のラジオトレーサー活性(すなわち放射能)を測定し、測定時間を記録します 2. 放射性トレーサーが被験者に注射された時間を記録します 3. 注入後のシリンジ(および容易に利用可能なチューブおよびその他の部品)の残留活性を測定し、測定時間を記録します。 4. プロトコールに規定されている放射性トレーサーの量を注入します。 これらの値は、PET / CT取得中にスキャナーに入力されます。 残留活性の情報を入力しないスキャナーの場合、すべての測定値を注入時間に減衰補正し、注入前の放射能から残留放射能を差し引くことで、注入された純粋な放射能計算を手動で行う必要があります。 その後、注入された純粋な放射能は、PET取得中にスキャナーに入力されます。 こちらの投与活性に関するすべてのデータは文書化されなければなりません。 すべてのデータは、共通データ形式メカニズムに入力する必要があります(付録E)。 |
3.1.3.1.3 放射性トレーサー投与経路
アミロイド標的ラジオトレーサーは、(21ゲージ以上の)留置カテーテルを介して太い静脈(例えば、前肘静脈)に静脈内投与されます。これは通常、手動注入により投与されます。パワーインジェクターは、アミロイド沈着のSUVR測定値を動的測定値(BPND)と比較する研究に特に使用する場合があります。他の静脈アクセスが確保できない場合を除き、静脈ポートは使用しないでください。ポートを使用する場合は、通常より多くフラッシュする必要があります。定量化を目的とした場合、再現性があり正確な放射性トレーサー投与が必要とされるため、血管外漏出や静脈周囲への投与は避けるべきです。浸潤または外部への漏出が疑われる場合は、その事象を記録する必要があります。注射部位の解剖学的位置は、適切な症例報告書または共通データフォーマットメカニズムに文書化する必要があります(付録E)。
CT造影剤は推奨されず、またプロファイルでサポートされていないことにご注意ください。
| パラメーター | エンティティ/アクター | 仕様 |
| アミロイド放射性核種投与 | 技師または医師 | 技師または医師は、留置カテーテル(24ゲージ以上)を用い、なるべく太い静脈(例えば、前肘静脈)にアミロイド放射性トレーサーを静脈内投与します。他の静脈アクセスが確保できない場合を除き、静脈ポートは使用しないでください。 放射性トレーサー注射後に少なくとも10ccの生理食塩水(0.9%NaCl)を流すことができるよう、三方活栓システムを静脈内カニューレに取り付けなければなりません。 |
| 浸潤または外部漏出が疑われる場合 | 技師および/または医師または物理士 | 技師は 1. 事象と推定されるアミロイドトレーサーの量を、軽度(推定5%未満)、中程度(推定5%以上20%未満)、重度(推定20%以上)と記録します。画像および/または既知の注入量に基づいて推定されます。 2. 浸潤部を画像化します。 事象と推定されるアミロイドトレーサーの量を共通データフォーマットメカニズムに記録します(付録E)。 |
3.2. 画像データ収集
このセクションでは、ゲルマニウム源を使用した減弱補正を行う条件下で、PET / CTまたは専用PETスキャナーのいずれかを使用してアミロイド-PET検査に実施されるイメージングプロトコールおよび手順を要約しています。脳の減衰を測定せず、減衰および散乱補正の計測に計算されたアルゴリズムを使用するPETスキャナーは、このプロファイルから除外されることに留意してください。さらに、このバージョンのプロファイルでは、新規性のためPET / MRスキャナーは含まれていません。PETアミロイドデータを定量化する上での相違点を理解するには、PET / CTや専用PETスキャナーと比較してこれらのスキャナーではより多くの研究とデータが必要です。この文書では、PETスキャナーはPET / CTまたは専用PETスキャナーのいずれかを意味しています。
一貫性を保つために、臨床試験の被験者は、研究の全過程にわたって同一の装置で画像化される必要があります。もしスキャナー装置が代用される場合は、そのことを臨床試験のスポンサーに通知するの必要不可欠です。
定量画像要件の臨床試験では、代替スキャナーとの定量的同等性が明示されていない限り、被験者は単一のスキャナーのみで撮像される必要があります。しかし、スキャナー間の定量的等価性を実証するための基準は現在のところ存在しないことに留意してください。このプロファイルの将来のバージョンでは、その基準が記載されることが予想されます。
被験者のアミロイドPET撮像を複数の時点で行う場合(縦断的要求)、フォローアップの撮像は初回(ベースライン)と同じ取得パラメーターで実行する必要があり、CTおよびPETの両方の取得に必要なすべてのパラメーターが含まれます(このセクションで後述します)。
アミロイドトレーサーPET / CTは以下の順序でイメージングを行います。
- CTスカウト(すなわち、トポグラムまたはスキャノグラムなど)、続いて(ある時点での被験者に対して、同じシーケンスが確実に行われることが保証されれば)次の2回の画像取得はいずれの順序で行われても構いません。
- 解剖学的定位および減弱補正のためのCT(非造影)
- PETエミッションスキャン取得
専用PETシステム(CTなし)で行われるアミロイド トレーサースキャンでは、上記の最初の2つのステップは実行されません。代わりに、ゲルマニウム源の減衰補正スキャンを実行してから、PETエミッションスキャン取得を続行してください。
理想としては、すべての時点における被験者の一貫性を保つ目的(縦断的有益性)で、このセクションに記載されている問題は、すべての施設および被験者(被験者間、施設内および施設間)の一貫性について扱われる必要があります。各時点での各被験者の実際の画像詳細は常に記録されなければなりません。
3.2.1イメージング手順
画像検査は、PETエミッションスキャンとトランスミッションスキャンの2つの要素(CTまたはゲルマニウム源のいずれかで実行)から構成されています。これらのデータセットから、品質管理目的に非減衰補正PET画像が再構成され、定性的解釈および定量分析のために減衰補正PET画像が再構成されます。取得デバイスに関連する機器仕様は、第4.0項「適合手順」に記載されています。
3.2.1.1画像データ取得のタイミング
アミロイドトレーサー集積は、放射性トレーサーごとに異なる複数の変数に依存して、異なる速度およびピークで様々な時間により増加しうる動的過程です。したがって、(1)一般的には、アミロイドトレーサー投与と放出スキャン獲得の時間間隔が一貫しており、(2)同じ被験者についてスキャンを繰り返す場合、様々な時点で実施されたスキャンでの注入と取得の時間間隔を同一にすることが不可欠です。
| パラメーター | フロルベタピル (アミヴィッド) [1] |
フルテメタモール (ビザミル) [2] |
フロルベタベン (Neuraceq) [3] |
NAV4694 |
| トレーサー集積時間 (mpi = mins post injxn) |
30 – 50 mpi | 90 - mpi | 45 - 130 mpi | 50 – 70 mpi |
| 画像取得の期間 | 10分 | 20分 | 15 – 20分 | 20分 |
「標的」トレーサーの集積時間は、使用された放射性トレーサーに依存します。現在利用可能なトレーサーそれぞれの許容されるトレーサー集積時間(注入後の分数[mpi])は上記の表を参照してください。正確な投与時間を記録しなければなりません。ラジオトレーサーの投与時間と記録されるべき時間として、投与開始時刻が使用されるべきです。投与される静脈の損傷を避けるため、注射およびフラッシュは、アミロイドトレーサー投与のために確保された静脈の状態に適した注射速度で1分以内に完了されるべきです。
同じ被験者のフォローアップスキャンを行う場合、特に治療反応評価の場合では、同じ時間間隔で行われる事が不可欠です。被験者の縦断的な撮像での変動を最小限にするべく、トレーサー集積時間は各時点で正確に同一でなければなりません。変化のない状況でトレーサー集積時間を変化させた場合のSUVRへの影響を定量化した科学的文献は現在のところ存在しません。このプロファイルにとって実用的かつ理想的なバランスをとるため、合意された推奨(The consensus recommendation)としては、±5分の幅が目標となります。
科学的な理由から、特定のプロトコールで(活性管理とスキャン取得までの時間が)別の時間が指定されている場合は、この偏差の根拠を述べる必要があります。つまり時間点の一貫性を維持しなければなりません。
| パラメーター | エンティティ/アクター | 仕様 |
| トレーサー注入時間 | 技師 | アミロイドトレーサー注入時間は、取得中にPETスキャナーコンソールに入力されなければなりません。 |
| トレーサー摂取時間 | 技師 | 技師は、ベースラインスキャンのトレーサー集積時間を特定の放射性トレーサー集積時間の許容範囲内に確実に収める必要があります(3.2.1.1項のトレーサー取り込み表を参照)。 同じ被験者、特に治療反応評価においてスキャンを繰り返す場合、過去に用いた時点と±5分以内の時間間隔を技師は採用しなければなりません。 |
以下のセクションでは、画像手順について説明します。
3.2.1.2被験者のポジショニング
適切かつ一貫した被験者の頭部位置決めは、アミロイドPET撮像にとって極めて重要です。被験者が適切な姿勢をとるだけでなく、スキャンセッション中にその姿勢を快適に維持できるようにするため時間をかけることが重要です。過度の動き、特に減衰補正のために使用されるエミッションスキャンとトランスミッションスキャンとの間の被験者の位置違いが、研究の失敗となる最も一般的な原因の一つです。
注:プロファイル要件を全体的に適合させるため、頭部の動きを最小限に抑える(そしてS-N(signal to noise)を最大にする)方法が非常に重要です。これは(直後の段落で説明されている頭部固定技術の使用を通して)画像取得時と画像取得の準備および再構成時の両方で取り扱われる可能性があり、これは3.3.2.2.1項で記載されています。
被験者をPET / PET-CTの寝台の上で、頭部/首をリラックスさせた姿勢にします。頭部の動きを最小にするため、被験者の頭部は施設の頭部ホルダー/固定装置(例えばサーモプラスチックマスク、テープなど)を使用して固定される必要があります。頚部を十分に支えるために頚部の下にパッドを追加する必要がある場合もあります。この過程では真空ビーンバッグも使用できます。頭部は、眼の外眼角と外耳道との間の仮想線にほぼ平行に配置されるべきです。追加サポートのため、頭部の横にフォームパッドを配置することが可能です。 頭部の位置を固定するには、ベルクロのストラップやテープを使用する必要があります。
スキャナーのFOV内に全脳が確実に含まれるよう被験者の頭部の位置を決める必要があります。その後の定量化の参照領域とするため、小脳全体が画像に含まれるように特別注意を払う必要があります。
専用のアミロイドトレーサーPET脳スキャンの場合、両腕を体幹に沿って下方に配置します。全検査中に渡って、被験者が体幹に沿って腕を維持することが身体的な問題で困難な場合、腕を胸または腹部に配置することができます。
これらの負担を軽減するため、背面および/または足の下にサポートデバイスを使用してください。これは下半身の動きを安定させるのに役立ちます。
技師は、被験者の姿勢に悪影響を与えたり、従命能力を制限する要因を記載しておきます(例:体動はみられなかった、など)。
| パラメーター | エンティティ/アクター | 仕様 |
| 被験者ポジショニング | 技師 | 技師は、すべてのスキャンで一貫した特定のプロトコール仕様に従って被験者を配置する必要があります。 |
| 姿勢保持の遵守不能 | 技師 | 技師は被験者のポジショニングの遵守不能に関する問題点を文書化します。 技師は、共通データフォーマットメカニズムを使用し、呼吸および位置の遵守不能に関する問題点を文書化するものとします。(付録E) |
| パラメーター | エンティティ/アクター | 仕様 |
| 体動の遵守不能 | 技師 | 技師は、静止維持の遵守が困難な被験者に関する問題点を文書化するものとします。 技師は共通データフォーマットメカニズムを使用して、被験者の体動遵守不能(静止維持できない)に関する問題点を文書化します。(付録E) |
| パラメーター | エンティティ/アクター | 仕様 |
| フォーマット メカニズム (付録E) |
3.2.1.3スキャン範囲と方向
解剖学的範囲は頭蓋底から頭頂を含み、小脳が完全に含まれている事を確認してください。解剖学的範囲はシングルベッドの位置で含めなければなりません。
| パラメーター | エンティティ/アクター | 仕様 |
| 解剖学的範囲 | 技師 | 解剖学的範囲(頭頸接合部から頭頂までの全脳を含む)がプロトコール仕様に従ってシングルベッドポジションで取得され、毎回同様の範囲が得られるように、技師がスキャンを行います。 |
3.2.1.4スキャナー取得モードのパラメーター
我々は取得モードパラメーターを実際のPETスキャンの開始時に技師によって指定されたパラメーターと定義します。これにはシングルベッドポジションの取得時間と取得モード(3Dモードのみ)が含まれます。これらのパラメーターには、スキャンプロセス全体の前(例えば、18 F-アミロイドトレーサーの注入量または取り込み持続時間)またはその後の(例えば、再構成パラメーター)取得形態を含みません。
PETの取得
可能であれば、PETデータはリストモードで(頭の動きを補正するため最大の柔軟性を得るために)取得するか、または最大5分間ごとの複数の収集に分割する必要があります。個々のサイト固有の取得パラメーターは、適切なファントムを使用してキャリブレーションに基づいて決定される必要があります(下記参照)。
| パラメーター | エンティティ/アクター | 仕様 |
| PET取得 モード |
研究スポンサー | 重要な3-D PET取得モードのパラメーター(例えば、ベッド位置当たりの時間、取得モードなど)は、スキャナーの製造元およびモデルにかかわらず同等の結果を生じると予想される方法で明記されています。 |
| 重要な取得モードのパラメーターは、所定のハーモナイゼーションパラメータに従って指定しなければなりません。 | ||
| PET取得 モード |
技師 | 重要なPET取得モードパラメーター(例えば、ベッド位置毎の時間、取得モードなど)は、研究プロトコールによって指定され、またすべての患者スキャンに対して一貫して使用されるように設定されます。 |
| PETはリストモード形式(これが最良とされます)またはそれぞれ5分以内の動的時間枠で取得する必要があります。 |
CT取得
PET / CTスキャンのCT取得コンポーネントに関して、このプロファイルではPET画像の定量精度に関連する点のみを扱います。換言すれば、このプロファイルではCT診断精度の点は扱いません。原理的には、どのようなCT技術(kVp、mAs、ピッチ、コリメーションを含むパラーター)でも減衰と散乱の正確な補正ができます。しかし、PETトレーサーの骨への取り込みの推定では、より低いkVpでのCT取得でより偏りうることが示されています。したがって、一般に、より高いkVp(80kVp以上)のCT取得が推奨されます(Abellaら)。さらに、取得パラメーターの選択(例:CTのFOVの切り捨て)のためにCT画像内にアーチファクトが生じる可能性がある場合、CTベースの減衰と散乱の補正を通してアーチファクトのPET画像への電波を最小限に抑えるべく、これらのパラメーターは適切に選択されるべきです。
各時点での、被験者個人の実測kVpおよび曝露(CTDI、DLP)を記録する必要があります。CT線量曝露は可能な限り、特に小さい患者では適切に選択されるべきです。放射線量を最小限にするための放射線原則ALARA(As Low As Reasonably Achievable)は、イメージングプロトコール開発中に考慮する必要があります。アミロイドイメージングに特化したものではありませんが、成人医療画像における放射線安全に関する一般的な情報を提供してくれるImage Wisely(www.imagewisely.org)などの教育イニシアチブを参照してください。ALARAの原則は放射線軽減のためのものであり、イメージングテストの診断実用性には対応していないことに注意してください。
| パラメーター | エンティティ/アクター | 仕様 |
| CT取得モード | 研究スポンサー | 主要なCT取得モードのパラメーター(kVp、mAs、ピッチ、およびコリメーション)は、スキャナーの製造元およびモデルにかかわらず、同等の結果をもたらすと予想される方法で、またCTスキャンの役割(つまり診断用CTスキャン、解剖学的部位、または減衰および散乱の補正)と一貫した最低線量で、明記されています。 |
| 診断的または解剖学的部位のCT画像が必要でない場合、CT取得モードは、被験者にできるだけ少ない線量(例えば、超低線量プロトコル)を提供してくれ、かつ減衰および散乱補正の定量精度を保持するプロトコールを利用します。 | ||
| CT取得モード | 技師 | 主要なCT取得モードのパラメーター(kVp、mAs、ピッチ、およびコリメーション)は、研究プロトコールで指定されたとおりに設定され、またすべての被験者スキャンで一貫して使用されます。 |
| CT取得モード | 技師 | 研究プロトコールでCT kVpが指定されていない場合は、最小100kVpを使用し、またすべての被験者スキャンに一貫して使用します。 |
| CT技術:プロトコールデザイン | 技師/医師/物理士 | 技師/医師/物理士からなるチームは、診断目的を達成するのに必要最低限の放射線線量であるようにCTプロトコールが設計されていることを確認にしなければなりません。 プロトコールは記録され、文書化されなければなりません。 |
| CT技術:線量暴露 | 技師 | 技師は、CTの線量暴露が診断目的を達成するのに必要最低線量であることを確認にしなければなりません。 |
CT放射線暴露に関しては、診断目的を達成するために必要な最小線量を使用する必要があります。与えられたプロトコールについて、CTスキャンを行う目的(すなわち、診断目的で意図されたものと比較して、減衰補正および/または解剖学的定位のためにのみ必要なのか)が決定されるべきです。必要なPET画像品質を達成するべく、使用されるCT技術(管電流、回転速度、ピッチ、コリメーション、kVp、スライス厚)は、合理的に達成可能とされる必要最低限の被爆となります。最初の研究で適切に実施されたと仮定して、その被験者のイメージングセッションで使用された技法を、その後のすべての時点で繰り返す必要があります。
3.3.画像データの再構成および後処理
3.3.1画像データの再構成
再構成された画像データは、PETスキャナー上の再構成プロセス、すなわち画像再構成中に生じる処理以外の処理をしていないPET画像ボリュームによって生成されたPET画像です。これは常にPET画像ボリュームを構成するDICOMスライス/ファイルの集積物であり、PETスキャナーコンソール、PET画像表示ワークステーション、PACSシステムなどのうちの1つ以上で解析することができます。 仕様については、セクション4.0を参照してください。
PET再構成パラメーターには、再構成アルゴリズムの選択、反復およびサブセット回数(反復アルゴリズムの場合)、平滑化のタイプおよび量、FOVおよびボクセルサイズが含まれます。PET画像の定量精度はCT再構成パラメーターの選択とは無関係でなければなりませんが、これは一様に検証されていません。さらに、処理パラメーターの選択(例:CTのFOV打ち切りの補償)のためにCT画像内にアーチファクトが生じる可能性がある場合、CTに基づく減衰と散乱補正を通したPET画像へのアーチファクト伝搬を最小にするよう、これらのパラメーターは適切に選択されなければなりません。
| パラメーター | エンティティ/アクター | 仕様 |
| PET画像 再構成 |
研究スポンサー | 主要なPET再構成パラメーター(アルゴリズム、反復、平滑化、FOV、ボクセルサイズ)は、スキャナーの製造元およびモデルに関係なく同等の結果をもたらすと予想される方法で指定されなければなりません。 |
| 重要なPET画像再構成パラメーターは、所定のハーモナイゼーションパラメータに従って指定されなければなりません。 | ||
| PET画像 再構成 |
技師 | 主要なPET再構成パラメーター(アルゴリズム、反復、スムージング、視野、ボクセルサイズ)は、被験者に対して毎度同一でなければなりません。 |
| PET画像 再構成 |
技師 | 利用可能であれば、点広がり関数(PSF)モデリングを使用する再構成アルゴリズムは使用しないでください。 |
| PET画像 再構成 |
技師 | 利用可能であれば、time of flight(TOF)のオプションが使用できます。TOFの使用または不使用は、被験者について毎度一貫していなければなりません。 |
| PET マトリックス/ボクセルサイズ | 技師 | 技師はマトリックス、スライス厚、および再構成ズームが、xおよびy次元で≦2.5mm、z次元で≦3mmのボクセルサイズを生成するように画像再構成を実行するものとします。最終的なサイズは、再構成画像の再ビンニングなどによって達成されてはなりません。 |
| 補正係数 | 技師 | すべての定量的補正は、画像再構成過程中に適用されるものとします。これには、減衰、散乱、ランダム、デッドタイム、および効率の標準化が含まれます。ただし、部分容積補正は行わないでください。 |
| 較正係数 | スキャナー | PET画像をBq / ml単位で出力するのに必要なすべての較正係数は、画像再構成プロセス中に自動的に適用されるものとします。 |
画像再構成及び分析の一部として、取得プロトコールからの既知の偏差に対する補正係数が潜在的に適用される可能性があります。既知のデータ入力エラー補正およびスキャナー較正係数の誤差補正は、再構成画像生成の前または直後に修正される必要があります。
3.3.2画像データの後処理
処理された画像データは、アミロイド負荷の測定を可能にする追加操作のため、画像データを準備するために何らかの形で変換された画像です。典型的には、いくつかの後処理操作はスキャンの直後にPET技師によって行われます。追加のステップは、核となるイメージングラボ、または放射線科医または核医学医師によってアクセスされた分析ソフトウェアパッケージによって実行されてもかまいません。
画像化部門において、PET技師によって典型的に実行される最初の後処理操作には、予め指定された離散フレーム持続時間および総フレーム数に画像時間フレームをビニングすることや、後処理プロトコールによって指定された空間方向に画像を置くことが含まれます。
各変換が画像信号をわずかに変える可能性があるため、後処理画像ではプロトコールごとに指定されたそれらのステップのみを実行する必要があります。そしてそれは真のPET画像値の数値精度を保持することが目的です。タイムフレーム後期での静的スキャン評価ではなく、フルダイナミックイメージングおよびキネティックモデリングを含む研究では、個々のプロトコールで指定されている追加処理が必要になる場合があります。
3.3.2.1 画像オリエンテーションの確保
臨床診断ソフトウェアを使用して医師が定量的に“読んだ”画像を作成する場合でも、一極集中化した画像品質管理・処理・分析を行う施設に送信する場合でも、画像がプロトコールごとに空間的に配向されていることを確認することが重要です。このステップは、プロトコールに含まれるアクターおよび画像転送シーケンスに応じて、以下の静止画像を作成する前後に行うことができます。
| パラメーター | エンティティ/アクター | 仕様 |
| 画像のオリエンテーション | PET技師 | 元画像は研究プロトコールごとに空間的に指向される。 |
3.3.2.2 静的イメージの作成
研究プロトコールに応じて、さらに処理され、SUVR測定に使用される後期タイムフレーム静止画像の作成には、1つもしくは複数のステップが含まれても構いません。最も単純な場合には、画像を単一のフレーム(例えば20分)として取得することができ、したがって時間フレームを結合する必要性がなく、静止画像が形成されます。この場合、以下のセクション3.3.2.2.2は適用されません。被験者の動きを補正することができないため、この単一フレーム手法は、このプロファイルで目標とする許容誤差を超える変動リスクを増加させる可能性があります。代替的に、そして臨床試験で一般的とされるのは、出力が後続ステップにおいて、単一の静止画像に結合される離散時間フレーム画像のセット(例えば5分フレーム×4回)であっても構いません。完全な動的データ取得の代替アプローチには、トレーサー注入直後に迅速に取得されるフレームから開始し、可変長の多数(15回以上)のフレームを通常は必要とします。
3.3.2.2.1 スキャン内時間フレーム間評価と位置合わせ
複数の時間フレームからなるスキャンの場合、フレーム間で測定するため同一の脳組織が同じ座標に位置するように、フレームが空間的に整列されることを保証することが重要です。この位置合わせは、エミッションスキャンとトランスミッションスキャン間の不整合による埋め込み誤差を防ぐために、減衰補正の前に(すなわち前述の3.3.2.2ステップの一部として)実行することが望ましいです。しかし現時点では、典型的なスキャナーワークステーションに備えられたツールの限界のため、画像再構成および減衰補正中に、時間軸間の位置合わせは通常行われません。むしろ、視覚的チェックが一般的には適用され、過剰な動きに注意をしてもしなくてもよいです。自動化された精密なツールが将来スキャナーワークステーションで使えるようになると、このセクションで記載されているフレーム間の位置合わせと静的画像形成が画像再構成過程の一部になる可能性があります。フレーム間の位置合わせが減衰補正の前または撮像施設で行われた場合でも、フレーム間の位置合わせやトランスミッションスキャン前の個別ビニングフレームおよび適用された位置合わせパラメーターを後処理および分析の段階での品質管理のために利用できるようにすることが重要です。フレーム間の位置合わせは、典型的には数学的フィッティングアルゴリズムを使用する自動化ソフトウェアを使用して、各時間フレームからの画像を基準に一致させます。基準フレームは、トランスミッションスキャンの時刻に最も近いもの(例えば、トランスミッションスキャンがエミッションスキャンに先行する場合には、後のフレーム取得の第1のフレーム)であっても構わなく、プロトコールごとに別途記載されるものであっても構いません。x方向、y方向およびz方向のそれぞれにおける平行または直線的な調整量および3つの直交する方向のそれぞれの回転量調整がソフトウェアによって測定されます。
ソフトウェアプラットフォームによっては、これらのパラメーターを画像分析者が検討するために利用可能であるか、合格/不合格または他の決定をするように予めプログラムされても構いません。大きな値(4度以上の回転または4mm以上の平行移動)は、特定のフレームから除去できないノイズ(信号変動性)を導入する1つ以上のフレーム内に、対象の動きが埋め込まれる可能性が高いことを示しています。さらに画像再構成でフレームごとに減衰補正が行われない限り、大きな値はエミッション‐トランスミッションスキャンミスアラインメント誤差も1つ以上のフレームに埋め込まれていることを示しています。
研究プロトコールは、参照フレームと他のフレームとの間で許容される平行移動および回転を定義しなければなりません。これらの限界を超えるフレームは、次の点に注意して除去することができます:(a)フレーム数が多すぎると(例えば、総取得ウインドウの半分以上など)、合計カウントが不十分になり、ノイズの多いスキャンが生じる可能性があり、 (b)同じ被験者に対して縦断的なスキャンにわたりフレーム除去を一貫させる必要があり、そうでないとわずかな誤差が導入されることがあります。特に、ある被験者集団では2mmまたは2度を超える並進運動または回転運動が観察されることは珍しくなく、5mmまたは5度を超える場合もあることにご注意ください。 MCIおよびAD患者の典型的な臨床研究では、中央値(標準偏差)は、最大平行移動は1.7(1.1)mm、最大回転は1.5(1.1)度となっています。長時間のスキャンでは動きが悪化する傾向があります。許容される動きの閾値を拡張する決定は、対象フレームを保持する事と信号変動の増大を許容する事との間のバランスの問題となります。
現在、ほとんどのスキャナーワークステーションでは、フレーム間の動きの測定と補正、および減衰補正前のトランスミッション(またはCT)スキャンに対する自動アラインメントのために、簡便に使用可能な自動ツールは用意されていません。そのようなツールが利用可能になると、後続フレーム間の位置合わせでは除去できない埋め込み減衰補正エラーを防ぐために、フレーム位置合わせの活動を減衰補正に先立って行うのが最適となります。時には、現在のツールであっても、施設において実行可能です。画像施設での再度の位置合わせが実現可能になった場合でも、元のスキャン取得のフレーム間位置合わせパラメーターは、画像分析者に利用可能とする必要性があり、特定条件下において、フレーム内の十分な動きが、フレーム間補正に関わらず、そのフレーム除去に値するということが生じていたかもしれません。
| パラメーター | エンティティ/アクター | 仕様 |
| 時間枠間の 一貫性 |
画像分析者、または未決定のプロトコール、PET技師 | マルチフレームPETスキャンが提供される場合、フレームを単一スキャンに結合させる前に、フレームを位置合わせするため要求される並進および回転調整が評価されます。時間枠一貫性チェックに基づくアクション 画像分析者、または未決定のプロトコール、PET技師 減衰補正の前にフレーム間位置合わせが実行された場合、フレーム間の平行移動が推奨される閾値4mmを超えるか、またはフレーム間回転が4度を超えた場合(研究プロトコルで示される場合はそれ以下)、または減衰補正の前にフレーム間位置合わせが実行されない場合、減衰補正に使用されるCTスキャンの位置からフレーム間の平行移動が推奨される4mmの閾値を超えるか、フレーム間回転が4度(または研究プロトコールで示されている場合はそれ以下)の推奨される閾値を超えると、フレームが削除されます。 |
3.3.2.2.2 離散時間フレームの結合
適切に位置合わせされた時間フレームの全て、または部分集団が識別されると、さらなる処理および分析のため、合成画像が生成されます。 後期の時間フレームスキャンでは、時間フレームを平均化または合計して1つのイメージボリュームにすることによって実行されます。フルダイナミックスキャニングでは、アミロイド“rich”(高トレーサー結合を有する)およびアミロイド“poor”(低トレーサー結合)領域のシグナルを測定する、もしくは可能であれば血液測定を使用して、ボクセル値を決定するための連立方程式を解くといった、より複雑な手順を用いて“パラメトリック”画像を作製することができます。パラメトリック画像は、以下で説明する同じ関心ボリュームまたは下記の他の方法を使用して測定することができ、測定値がSUVRではなく分布容積比(DVR)になるという違いがあります。
| 静的画像生成 | 画像分析者または 画像処理ワークステーション |
この画像生成には、適切に位置合わせされたと識別された 時間フレームのみが含まれます。 |
3.3.3イメージングデータの保存と転送
PETデータのアーカイブについての議論では、しばしば‘生データ’が言及されます。これは、スキャナー生データ(サイノグラムまたはリストモード)または画像生データを参照できる曖昧な用語です。混乱を避けるため、どの形式が議論中であるかを明確にすることなく、生データという用語は使用すべきではありません。
画像生データは、PETまたはPET / CTスキャナーでの再構成プロセスによって生成された画像データです。すなわち、画像再構成中に生じる処理以外の処理なしにPET画像ボリュームを構成するDICOMスライス/ファイルのスタックです。典型的には、これはPETスキャナーコンソール、PET画像表示ワークステーション、PACSシステムなどのうちの1つ以上で解析することができるPET画像ボリュームを構成するDICOMスライス/ファイルのスタックです。減衰補正の前にフレーム間位置合わせが行われる場合、“生データ”は、フレーム間またはスキャン間位置合わせ前のエミッションおよびトランスミッションフレームの両方や、減衰補正に使用された再調整フレーム、減衰補正されたフレームを含みます。
後処理された画像データは、何らかの方法で再構成後に変換された画像です。これは通常、PETスキャナーコンソール、PET画像表示ワークステーション、PACSシステムなどのうちの1つまたは複数で依然として解析することができるPET画像ボリュームを構成するDICOMスライス/ファイルのスタックです。ローカル施設またはイメージングコアラボ(該当する場合)でアーカイブするためには、最も重要なデータは元画像、つまり画像生データです。(ローカル施設でアーカイブする必要がある)スキャナーの生データが後の再処理のために必要になるような万一の場合、これはプロトコール内で明確にされるべきです。
| パラメーター | エンティティ/アクター | 仕様 |
| データアーカイブ:生画像 | 技師 | 減衰補正された元々の再構成されたPET画像(画像生データ)およびCT画像は、常にローカル施設で保管しなければなりません。将来の再処理のため、スキャナーの生データをアーカイブする必要がある場合は、これをプロトコール内で前向きに定義する必要があります。 |
| データアーカイブ:後処理された画像 | 画像分析者 | フレームの位置合わせと離散時間フレームを合計または平均化、または他のパラメトリック画像生成を通じて、静止画像が生成された場合、静止画像生成が行われた施設でその画像がアーカイブされるでしょう。 |
3.4.画像分析
画像分析者は、ワークステーション分析ツールとのやりとりを通じて、画像上で特定の測定を行うことができなければなりません。画像解析には定性的・定量的な作業があります。両方のタスクは、高品質の画像提出と画像解釈の一貫性を必要とします。定量では、このプロファイルのセクション3.2、画像データ収集、およびセクション3.6、品質管理でさらに説明されている追加のシステム特性が必要です。
3.4.1入力データ
減衰、散乱、ランダムおよび放射性トレーサー減衰に対して補正された単一の画像ボリュームをもたらす画像再構成および後処理(静的画像生成を含む)の出力は、静的スキャン画像解析の入力と考えられます。動態解析のための完全なダイナミック撮影の場合には、後処理出力は時間フレームのセットであってもよいです。変更されていない受信されたオリジナルの入力データは、最終的に測定に使用される処理済みデータと共に保持される別個のファイル(またはファイルのセット)として維持されなければなりません(セクション3.2参照)。
3.4.2画質管理と準備
画像解析が行われる前に、画像が処理および分析に適していることを確実にするため、厳しい画質管理が不可欠です。再構成後処理を実行中に行われる生画質管理の各要因は、セクション3.3、処理後画像で定義されています。画像データのさらなる処理および分析の前に、画像分析者または処理ワークステーションソフトウェアによって実行されなければならない処理後画質管理の要点は、セクション3.6、品質管理に列記されています。
3.4.2.1部分容積効果の補正
部分容積効果補正(PVEc)は、これ自体がプロファイルの許容誤差の目標に対する大きなバラツキをもたらす可能性があるため、このプロファイルでは“デフォルトの”ステップとしては推奨されません。しかし、変動性を増加させない方法論が系統的に採用されている場合には、特定の研究プロトコールに含まれる可能性があるため、ここでこのステップを検討します。この話題の背景として、PETスキャナー解像度の限界のため、白質と灰白質、または組織および脳脊髄液(CSF)の境界で測定された信号は、同じボクセルの境界内の両組織からの影響を含んでいる可能性があります。
特に、アミロイドPETトレーサーには、非特異的な高レベルの白質の取り込みを有し、隣接する灰白質の測定値に“こぼれる”高い信号強度を生じさせるものがあります。加えて、神経変性患者では高度な進行性萎縮を示し、CSFからの流入を増加させ、萎縮組織成分に由来する増加を減弱させたり、減少幅を強調させることがあります。 PVEおよび萎縮組織を補正または補償するために、いくつかの異なる数学的アルゴリズムおよびアプローチが開発されています。しかしながら、これらのアプローチは、アミロイドの定量化設定において必ずしも適していません。脳灰白質の喪失分の補正を適用するだけで、画像信号強度がアップスケールされ、その適用は信号の組織起源が失われたときが最も適切であり、結果として萎縮(FDG脳グルコース代謝におけるシナプスニューロピルの喪失)が生じます。しかし、神経変性型認知症におけるアミロイド沈着の場合、沈着物は正常な脳灰白質要素に含まれません;アミロイドプラークは細胞外蓄積物であり、シナプスおよびニューロンが消失して灰白質が萎縮するにつれて、それが変性する可能性は低いです。したがって、灰白質の萎縮補正PVEcを適用すると、萎縮した皮質領域からのアミロイド信号が不適切に“アップスケール”される可能性があります。通常のPVEcアプローチは、典型的には灰白質のみを含む新しい画像をもたらし、AD患者の明らかなアミロイドを30%〜56%も増加させることが示されています。アミロイド画像におけるPVEcの最も賢明なアプローチは、皮質白質から灰白質領域へのスピルオーバー補正を適用することであり、皮質灰白質が萎縮するにつれてますます問題になる可能性が高まります。(ここまで)PVEcの適正使用は、縦断的な変化に対する感受性を高め、萎縮または白質の取り込みの変化に伴う誤差を減少させるのに役立つ可能性があります。しかしながら、PVEc法は変動性を導入する可能性があり、その結果、補正を計算する際に使用されるパラメーターの主観的選択に非常に敏感となります。縦断的な変化の測定に及ぼす影響は、効果なしから測定された変化が増加するまで変化しました。利点とこれらの考慮事項との間のトレードオフを考慮する必要があり、使用するかどうかの決定は研究に依存する可能性があります。プロセス中のPVE補正を適用する時期は、例えば空間的に標準化された画像またはネイティブ画像に適用するかは、SUVR画像の作成の前または後に変更されても構いません。
3.4.2.2画像の平滑化
複数のスキャナーおよび再構成ソフトウェアの組み合わせが、患者データを取得するため使用されているかどうか、および画像解析の目的に応じて、画像を平滑化する必要性があります。平滑化は各ボクセルの画像信号に数学的フィルタを適用して、異なるスキャナー間に存在する空間解像度の相違を補うのに役立ちます。特定の被験者の来院ごとに同じスキャナーが使用されたとしても、SUVRの値を複数のスキャナーからの画像を使って得られた閾値、または他のスキャナーで収集された他の研究被験者と比較することができるには、スキャナーの違いの調整が必要です。調整されていない場合、これらの差異はSUVRの数パーセントの差異を引き起こす可能性があります。
信号を“拡散”することにより、平滑化は異なる被験者にわたるアミロイド蓄積の空間的な重なりを増加させる助けとなり、ボクセルベース比較における群効果を識別する能力を高めます。しかし、平滑化は特に小さな構造においても信号強度を希釈し、また、白質および灰白質、CSF信号の混在を増加させる可能性もあります。
| パラメーター | エンティティ/アクター | 仕様 |
| 画像の平滑化 | 画像分析者 | 異なる画像解像度を生成する異なるスキャナーおよび/または再構成ソフトウェアからのスキャンを組み合わせる場合、プロトコールごとに同量の放射能に対して同等の信号を産出するためフィルタリングが適用されます。 |
3.4.3使用すべき方法
ラジオトレーサー、画像分析ワークステーション、ソフトウェアワークフロー、および研究デザインにおいて重要であると決定されたパラメーターに依存して、アミロイドトレーサー分析を実施するため使用される方法論および一連の作業は、歴史的に研究を通して変化してきました。処理と分析のステップは、手動ワークフローから半自動ワークフロー(ワークステーションとのユーザーのやりとりが必要)から自動ワークフロー(ユーザーとのやりとりがほとんどない、または全くない)であり、各ステップでさまざまな選択肢が可能です。典型的なワークフローに含まれる主な手順の概要を以下に示します。これらのステップは、平衡段階“後期時間フレーム”画像を使用するSUVR(Standardized Uptake Value Ratio)計算アプローチと関連しています。分析結果の信頼性に影響を与える詳細、考慮事項、ガイドラインが提供されています。ターゲット領域測定の前にSUVRイメージを生成するオプションのように、最終結果に影響を与えずに操作順序が変わる可能性がある点が記載されています。アミロイド負荷の測定値を生成するためのフルダイナミックスキャンと動態モデリングの代替使用についての注記も含まれています。
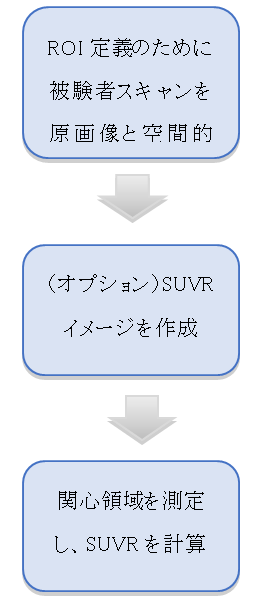 関心領域(ROI)が定義されている元画像と被験者のスキャンを空間的に一致させます。 これは被験者のMRIスキャンであっても、解剖学的領域に区分けされていても、または領域が予め定義された“テンプレート”MRIまたはPETスキャンであっても構いません。テンプレートを使用する場合、定義された領域を対象スキャンにマッピングできるように、テンプレートと対象スキャンを一致させるために空間変換または“ワーピング”が必要です。
関心領域(ROI)が定義されている元画像と被験者のスキャンを空間的に一致させます。 これは被験者のMRIスキャンであっても、解剖学的領域に区分けされていても、または領域が予め定義された“テンプレート”MRIまたはPETスキャンであっても構いません。テンプレートを使用する場合、定義された領域を対象スキャンにマッピングできるように、テンプレートと対象スキャンを一致させるために空間変換または“ワーピング”が必要です。
オプションのステップとして、スキャン内のすべてのボクセルを、選択された参照領域(小脳など)の平均測定強度で除算することによって、スキャンの強度標準化バージョン(「標準化された取り込み値比」または「SUVR」画像)を作ります。これは、視覚的な評価やスキャン間の比較に役立ちます。
目的の標的領域の境界(“マスク”)を適用し、平均強度を測定します。画像がすでに選択された参照領域に対して強度標準化されている場合、これらはSUVRに等しくなります。画像が強度標準化されていない場合、または異なる参照領域を使用する場合は、基準領域強度を測定し、目標領域強度を参照領域強度で除算してSUVRを計算します。他のボクセルベースの解析も実行することができます。
図4 SUVR計算のための画像処理および測定の典型的なステップ
適用可能なワークフローのばらつきにもかかわらず、いくつかの基本的な要因が測定の精度と再現性に影響する可能性があります。これらは以下に説明され、正確さと再現性を達成するためのガイダンスが提供されています。
3.4.3.1被験者とテンプレートの空間的一致
アミロイド研究のためのスキャンへの関心ボリューム(VOI)の適合は、典型的には、自動ソフトウェアによって実施され、主観性、読影者間の差異、および手動描写の労働強度を低下させます。
SUVR計算(またはフルダイナミックスキャンの場合はDVR)の事前定義されたVOIを測定するためには、これらの空間的境界を対象の特定の脳形態にマッピングするか、またはその逆にマッピングする必要があります。以下のアプローチを適用することができます:(a)個々の脳スキャンの事前定義されたVOI境界を有するテンプレート脳への空間マッピング; (b)灰白質セグメントまたはその他の線引きされた領域の確率的アトラスに基づくテンプレート脳および事前定義されたVOI境界の個々の脳スキャンへの空間的マッピング;(c)被験者のMRI(例えば、フリーサーファー)を用いて被験体の本来の形態内の目的の各解剖学的構造を“発見”するセグメンテーションアルゴリズムの使用。個々の被験者のスキャンを脳テンプレートにマッピングすることは、ボクセルベースの分析を用いてスキャンを互いに比較できるようにすることも必要とされます。セグメンテーションの結果は使用されるMRIシーケンスに依存します;同じシーケンスであっても、異なるMRIスキャナーで異なる結果を生成する可能性があります。
| 空間マッピング | 画像分析者/ワークステーション | プロトコ-ルで定義されているように 一貫して空間マッピングを実行します。 |
3.4.3.1.1“融合”MRIおよびPET画像
アミロイド試験・再試験研究の大部分および定量的アミロイドを用いた大部分の臨床試験では、上記の空間マッピングアプローチのための高分解能媒体として対象のMRIスキャンを使用しています。臨床応用を考慮して、特定のアミロイドPET放射性トレーサーを使用する処理パイプラインが、PETからPETへの空間変換を使用するために開発されてきました。フルテメタモールのために最適化されたPET-PET変換アプローチが開発されており、他のトレーサーに対しても同様のアプローチが開発されています。 MRIが使用される場合、被験者のMRIおよびPETは、自動ソフトウェアによって実行される線形変換を使用して、互いに“融合”または共に登録されます。 MRIまたはPETの一方が、もう一方の共に登録されるターゲットとして機能することができる一方で、MRIをPETに登録することは、PET画像の改ざんを防止します。しかし、MRI画像の分解能(通常元のPETの分解能よりも高い)を保持することは、MRIのセグメント化およびテンプレート空間への変換を含む後の操作に有用です。これは、PETをMRIに同時登録することによって、またはPET、MRIの両方を登録する前にPETをアップサンプリングすることによって、または出力解像度を保持することによって達成することができます。
MRI上で行われるマッピング操作は、一緒に登録されたPETスキャンに適用されるので、PETとMRIが互いに適切に位置合わせされていることを確認することが重要です。3つの平面(軸位断と矢状断、冠状断)すべてで左右の向きや位置合わせが適切かを注意深く視覚検査しなければなりません;定量的な適合度の尺度も適用することができます。正しいVOI配置および/または正しい空間標準化の検証を介して、融合が成功しているかを間接的にチェックすることができます。しかし、位置合わせの誤りが発生した場合は、プロセス内のどこで発生したかを判断するために引き返さなければならず、各ステップの検証が推奨されます。また、適合の良さを保証する自動化された方法を使用することもできます。
| パラメーター | エンティティ/アクター | 仕様 |
| PETとMRI画像の融合 | 画像分析者 | 被験者のPETとMRI画像とを共に登録する際、すべての平面(軸位断、冠状、矢状)における画像の正確な位置合わせが確認されます。 |
3.4.3.1.2縦断的なPET共同登録
縦断的なアミロイド測定では、別々のMRIからPETへの共同登録または別々の空間ワーピング操作(後述)がわずかに異なる位置合わせを生成する可能性があるため、ベースラインPETスキャンに後のPETスキャンを共同登録することをお勧めします。これはVOI測定の差異を引き起こすことがあり、数パーセントでさえ縦断的な評価で有意となり得ます。 PETスキャン間の位置合わせの適合性は視覚的に確認されるべきです;相関などの定量的な測定基準を適用することもできます。
成功した縦断的な共同登録が成功しているかは、正しいVOI配置の検証および/または正しい空間標準化を介して間接的に再度検査することができます。さらに、もし縦断的スキャンの別個の空間正規化を含むプロセスが適用され、適合が得られた場合は、その結果は許容可能です。しかし、位置合わせの誤りが発生した場合、プロセスのどこで起こったかを判断するために引き返さなければならないため、適切な縦断的共同登録の明示的検証が推奨されます。
| パラメーター | エンティティ/アクター | 仕様 |
| 縦断的スキャンの共同登録 | 画像分析者 | 被験者の縦断的PET画像を共同登録する場合、全方向(軸位、冠状、矢状)の画像の正確な位置合わせを検証します。 |
3.4.3.1.3 対象画像とテンプレート画像の空間マッピング
関心領域または参照領域をPETスキャンにマッピングするために取られる手法に応じて、画像とテンプレート画像間の空間変換(または“ワーピング”)が必要な場合があります。対象のネイティブ空間MRIを分割し、関心領域境界を定義するために使用され、ボクセルベースのグループ分析が実行されない場合、空間ワーピングは必要とされません。しかし、テンプレート空間にあらかじめ定義された領域をスキャンする場合、変換は重要なステップです。
対象画像とテンプレート画像間のマッピングは、自動化された空間標準化またはワーピングソフトウェアアルゴリズムによって達成されます。MRIを使用する場合、変換は被検体MRIとテンプレートとの間の“ワープ”によって決定され、同一の数学的変換が(テンプレート空間への変換の場合)共同登録されたPETスキャン、および/または(ネイティブの対象者スキャンの場合)関心領域へ適応されます。空間変換の精度はアルゴリズムに依存します。古いアルゴリズムと比較して、特定のソフトウェアおよびソフトウェアバージョンは、小脳、被殻や内側側頭葉領域といった深部構造、脳室の位置合わせに優れています(Klein et al, 2009)。
MRIが利用できない場合、被験者のPETスキャンは直接テンプレートPETに変換することができます。陰性アミロイドスキャン時の灰白質内の信号および灰白質と白質の強度のコントラストは、アミロイド陽性スキャンにおけるそれらとは実質的に異なるので、陽性および陰性の両極端の画像は空間的に標準化されないことがあります。これに対処するために、一連のテンプレート(Lundqvist et al, 2013)への適合をテストし、最適なものを選択するさまざまな手法が開発されています。 PETベースの空間標準化における他の混乱点としては、硬膜または頭蓋骨、または脳の頂点または底部の欠けた(切断された)組織においてアミロイドPET画像が高信号強度を有する場合です。これらの問題に対処するために、様々な追加ステップが使用されています。
空間標準化に使用される手法にかかわらず、被験者とテンプレートとの間の正確な一致は、アミロイド測定にとって重要です。適合の良さは視覚検査を使用して評価し、定量的な適合アルゴリズムを適用することもできます。注意として、“眼球運動”による1組のスライスの適合を変更することで、他のスライスに誤差を導入する可能性が非常に高いため、ワーピング結果の臨機応変な手動(例えば、タッチスクリーンまたはマウスベースの)修正は使用すべきではありません。
| パラメーター | エンティティ/アクター | 仕様 |
| テンプレート画像による空間マッピング | 画像分析者 | 被験者の画像とテンプレート画像を互いに空間的にマッピングするとき、全方向(軸位、冠状、矢状)の画像の正確な位置合わせが視覚的に確認されます。 |
3.4.3.2 VOIの配置:ターゲット/リファレンス
3.4.3.2.1測定対象領域の決定
アミロイド測定のための標的領域の選択および描写は、研究目的に応じて異なり、プロトコールに明記されるべきです。臨床応用のため、一部の製造業者は、剖検データと相関した閾値SUVRに関連する所定のVOIを指定しています。いくつかの臨床試験では、4-6領域からなる皮質平均を使用し、個々の局所的アミロイド測定値に更なる情報を提供しています。より閾値に近いアミロイドレベルを有する“新生”被験者を臨床試験で研究する場合、特定の亜領域の分析が重要になることがあります。
特定の解剖学的領域(例えば、前頭回や帯状回)が与えられた場合、その領域に含まれる組織を定義するいくつかの方法、および相互排他的ではない、いくつかの検討事項があり、以下に列挙されています。手動定義に関連しうる高い主観レベルを考慮すると、領域定義の自動化は重要です。
- 領域の境界:解剖学的領域全体を使用する手法もあれば、アミロイド負荷が最大になるように経験的に決定された亜領域を定義する手法もあります。
- 領域を被験者の解剖学的構造と一致させる方法: いくつかの方法は、領域定義(基準脳に基づいてあらかじめ定義された解剖学的境界)の基本的なアトラスを適用し、被験者の形態とアトラステンプレートとの間の変換により、アトラスの領域を被験者に一致させます。これらは、“確率的”領域と呼ばれることがあります。他の手法では、個々の対象のMRIに基づいて解剖学的境界を推定し、アトラスの参照情報をより複雑な方法(例えばFreesurfer)で組み込みます。
- 灰白質への領域閉じ込め: アトラスベースの領域が適用される場合、これらは対象のMRIからの灰白質セグメントを使用して閾値処理(制限)されても、されなくてもよいです。このマスキングは、テンプレート領域と被験者の実際の形態との間の位置合わせを保証するのに役立ち、ネイティブ空間画像またはワープ画像のいずれかを使用して行うことができます。
- 周辺組織またはCSFからの領域侵食: 萎縮効果や灰白質以外のものからの溢流を減少させるために、隣接するCSFおよび白質からVOI境界が侵食(例えば、1~2ボクセルだけ周囲を減少させる)されても構いません。これは、より大きく、灰白質に隣接する組織を取り込む傾向がある確率的領域に適用されることが最も多いです。
"ネイティブスペース"と "テンプレートスペース":VOIは、被験者のワープスキャンを測定するためテンプレート空間でのみ定義されるか、または被験者のネイティブスキャンに変換されます。ネイティブスキャンを使用すると、対象の解剖学的構造を伸張または圧縮することによって生じる補間および信号の変化を低減することができます。
ネイティブスキャンとテンプレートスキャンのどちらを使用するかを含む、領域の定義に対するさまざまなアプローチの比較では、高い相関係数が得られています(Landau et al、2013)。しかし、組織の異なる部分の測定が異なる結果を与えることに注意が必要です。それゆえ、同じ組織の定義をスキャン中および研究内の被験者にまたがって適用することが重要です。
| パラメーター | エンティティ/アクター | 仕様 |
| 標的領域の 定義 |
画像分析者 | 同じ標的領域の定義(これは個々の被験者の形態に変換されます)は被験者に一貫して、そして研究を通して適用されます。 |
3.4.3.2.2.参照領域の決定
参照領域の定義は、画像解析の最も重要な側面の1つです。参照領域が画像比較に使用されます。なぜなら、注入された線量、スキャナーのキャリブレーション、またはアミロイドとは無関係の他の要因のために、同じ被験者の生の画像カウントがスキャンごとに変化するためです。これらの要因により脳内の全ての領域が同じ割合で変化する場合、そのような変化は標的領域対参照領域の比を取ることによって相殺されます。参照領域は典型的には、アミロイドを蓄積または失わない領域であり、アミロイドの検出による標的領域の変化を可能にします。
トレーサーの製造業者と有力な研究機関がこのテーマに関して食い違い、進化し続けているため、このプロファイルは特定の参照領域を指示していません。しかし、特定の参照領域の縦方向の変動が少なく、最適な参照領域はラジオトレーサーごとに異なる可能性があるという証拠が増えています(Villemagne、AAIC 2015)。さらにスキャナーから生じるばらつきを最小にし、基準測定の妥当性を保証するために、特定の実行に従う必要があります。これらの考察は以下で議論されます。
小脳皮質(灰白質)は、典型的に線維アミロイドを蓄積しないこと、また灰白質の組織動態が標的領域と合理的に一致すると考えられることから、アミロイドの多くの研究において選ばれる基準領域でした。低信号および結合の欠如のため、小脳皮質は断面差を測定するための最も感度の高い基準を示します。しかしその信号レベルが低いため、小さな値の動きは計算されたSUVRで大きな動きとなります。さらに、スキャナーの横軸のFOVに向かう小脳の物理的位置は、エッジノイズ、散乱、および組織の排除(特に軸方向のFOVがより短いスキャナーで)の影響を受け易いです。
頭部の回転および放射送信ミスアライメントでは、小脳皮質の後縁が特に影響を受ける可能性があります。さらに、位置のわずかなシフトは、白質と灰白質の混和を引き起こし、基準測定に影響を与える可能性があります。さらに、横断像で小脳はいくつかの典型的な標的VOIに近接しておらず、技術的要因によりこれらのスライスにおける信号は同じように変化しないことがあります。縦断研究では、1つの放射性トレーサーについて、小脳皮質は経時的に安定性を示すことが示されています(Villemagne、AAIC 2015)が、測定された変化に関するばらつきが示され、統計力が低下します。断面測定においてさえ、小脳(またはいずれかの参照領域)に埋め込まれた技術的ノイズは、アミロイド負荷が陽性の閾値にある被験者に、一方向または他の方向に「tip」をもたらす可能性があります。
最低限、小脳の基準境界の下限は、最大の技術的変動性が生じるFOVの縁まで広げてはなりません。雑音がSUVR結果を駆動していないことを保証するために、代替参照領域の比較も推奨されます。
小脳全体の使用はいくつかのリガンドでの選択の基準として規定されており、既に含まれているため、より多くの白質を含むシフトから生じる変動を減少させることができます(Joshi、JNM 2015)。しかし、空間的な位置、エッジノイズ、および平均信号の低下に関する同じ問題が依然として適用されます。代わりの参考文献として、橋は複数の研究に適用され、わずかに変動性が少ないことが判明しました。その利点には、白質が含まれることによるより高い信号、およびスキャナーの横軸の視野のエッジから少し離れたところの脳内のより中心位置にある点があります。フレルベルタピール、フルテメタモールおよび11C-PIBを用いたいくつかの研究では、橋は小脳の参照領域(参考を含む)よりも低い縦方向可変性を示すことがわかりました。しかし、細い円筒形の大きさと形の橋は、被験者の動きに対して脆弱になり、技術的なばらつきの影響を受ける可能性もあります。皮質下白質は別の代替参照領域を提供し、より高いシグナル、より大きな測定量、関心のある標的領域との軸方向の整列という利点があります。研究は、他の参照領域(参照が必要)と比較して、皮質下白質を用いたより低い変動性、および縦方向の変化を測定する際の統計力が大きいという利点を示しています。白質参照の使用における1つの考慮点は、白質の動態特性が灰白質の動態特性と異なり、測定の妥当性に不明確な影響を及ぼすことです。しかし、期待される所見は灰白質で見られるアミロイド陽性集団の増加を検出する能力を支持するようですが、変動性は低いです。小脳全体、橋、皮質下白質あるいは小脳白質、橋あるいは小脳以外の「アミロイド貧弱」灰白質、の組み合わせもまた(複合参照領域を正当化するための参照を加える)統計力を増加させる(フレルベルタピアのための)縦方向可変性の低下を伴って適用されています。
しかしながら、皮質下白質を使用する参照領域からのシグナルは、高齢者に共通する血管病変によって影響され得ることに留意すべきです。
陽性の閾値近くの被験者における縦断研究およびアミロイドの測定のために、標的領域に近接した組み合わせ基準、皮質下白質、または他の「アミロイド不十分」領域の使用が推奨されるかもしれません(放射性トレーサー依存性)。基準領域のクロスチェックは、参照領域の信頼性をスクリーニングするためにも使用できます。
| パラメーター | エンティティ/アクター | 仕様 |
| 標的領域の 定義 |
画像分析者 | 参照領域の定義は、指定された組織を含めプロトコールに準拠します。 品質管理措置が適用され、縦方向の変化は技術的なノイズまたは特定の参照領域内のアーチファクトに起因しないことを保証します。 |
3.4.3.2.3.被験者スキャンに領域を適用して測定
標的VOIは、非強度の正規化画像または各ボクセルを参照領域の平均値で除算することによって、最初に生成されたSUVR画像のいずれかに測定に適用することができます。VOIを配置する際には、正確な合致を確保することが重要であり、適切な組織だけが含まれていることが重要です。潜在的なエラーの原因には次のものがあります。
組織組成の相違:白質に対しての第2の縦方向スキャンに対して1スキャンで灰白質の端に向かって皮質VOIを配置すると、組織組成および部分的体積効果による測定誤差が起こります。横断面測定では、これらの差異も、陽性閾値の被験者にとって有意となり得ます。
組織切断:小脳または他の領域を完全にスキャンされずVOIが空の空間をサンプリングする場合、VOIの欠損組織の割合によって大きな誤差が生じる可能性があります。
サンプリングされた組織の差:縦方向スキャンで組織の異なる部分(例えば、組織切除による第2のスキャンに対する1回目の全体スキャン)を測定すると、数〜数%の誤差が生じることがあります。
| パラメーター | エンティティ/アクター | 仕様 |
| 領域の配置 | 画像分析者 | すべての関心領域と参照領域の配置が正しい組織上にあることを確認します。 |
| 領域の配置 | 画像分析者 | すべての領域で境界が確認され、空のスペースは含みません(スキャン切り捨て)。 組織が欠損しているボクセルを排除するため、領域はサブ閾値を用いたボクセルの自動除外のような、一貫したアプローチを用いて調整されます。 |
| 領域の配置 | 画像分析者 | 組織の同じ部分は、同じ被験者の縦方向スキャンの間で測定されます。 |
3.4.3.2.4.SUVRイメージ生成
基準領域がスキャンに適用され、ターゲット領域測定の前、またはその後に、SUVR画像(または完全に動的なスキャンの場合はDVR)は、各ボクセル値を基準領域平均で分割することによって任意に生成することができます。
これは、どの領域を定量的に測定するかにかかわらず、画像の視覚的比較および評価に有用です。SUVR画像が生成されると、ターゲットVOIを適用することもでき、基準領域値によってさらに分割することなく測定されます。
3.4.3.3. SUVRの作成
3.4.3.3.1.領域価値の測定
各VOI内の平均値はSUVRの分子として計算されます。皮質平均は、複数のVOIの平均として計算されてもよいし、各VOI内のボクセルの数によって重み付けされてもよいです。
3.4.3.3.2.SUVRの計算
SUVRは、VOI値を基準領域値(SUVR画像上で測定される場合には1.0です)で割ることによって計算されます。フルダイナミックスキャンを使用してパラメトリック画像が生成された場合、またはマルチタイムフレームのダイナミック画像にキネティックモデルが適用されている場合は、代わりにDVR値が生成されます。
3.4.3.3.3.SUVR値の他の研究への関連付け
異なるプロトコールは、異なるトレーサー、標的領域、および参照領域を含みこれら全てはSUVRがアミロイド負荷に関してどのように解釈され得るかに寄与します。例えば1.2の値は、分析のための1つのトレーサーおよび/または1組の領域を使用するアミロイド陽性であるが、異なるトレーサーおよび/または領域を用いるアミロイド陰性であり得ます。データの取得、処理、分析の各プロトコール間で結果を調和させるために、セントロイドの概念が開発されました(Rowe et al、2013)。セントロイドは、データの取得と処理の方法を指示するのではなく、得られた結果を広範囲のプロトコールパラメーターで同等にする方法を提供することを目的としています。セントロイドの基礎は、若い健常者および高齢AD患者に由来する結果の「ゴールドスタンダード」のセットです。これらの結果は、ラジオトレーサー11C-PiBおよび標的領域、参照領域、および画像処理および分析ステップの定義されたセットを使用して生成されています。0(アミロイドなし)から100(アミロイド陽性散発性AD患者を意味する)までの値の直線数列は、これらの値を用いて確立されています。ゴールドスタンダードとは異なるトレーサーおよび/または獲得および分析プロトコールに相当する「センチロイド値」を確立するために、2組の関係が経験的に導出されます。セントロイドプロジェクトによって提供される調節画像セットを使用すると、所定の領域および分析手法を使用することによってx%を超える相関で値を生成できることが最初に確認されます。第2に、新しいトレーサーおよび/または取得と分析パラメーターを使用して、「ゴールドスタンダード」法および11C-PiBならびに代替トレーサーおよび/または方法の両方を用いて値が生成されます。2つのセットの結果間の回帰は、他の研究との比較のために結果を「センチロイド単位」に変換する変換式をもたらします。セントロイド単位への変換がすでに確立されているトレーサーおよび一連のアプローチが適用されている場合、この参照変換は同じパラメーターを使用する新しいスタディに適用できます。
3.4.4.結果データの必要特性
特定の試行プロトコールは、画像終点に必要なSUVR(測定対象領域、適用可能な皮質平均に含まれる領域、および平均をどのように計算するか)を前向きに定義するものとします。ソフトウェアバージョンを含むSUVR測定値およびそれらを得るために使用される分析ツールは、各プロトコールについて指定されなければならず、すべての被験者、すべての順次測定で使われなければなりません。
どの値がどの脳領域に属するのかは明らかでなければなりません。レポートでは、半球参照を含む領域を列挙し、見出しやその他の情報表示を介して測定値と明確に関連付ける必要があります。
価と領域の正確な関連性は、文書化によって保証されるべきです。この情報を正しく生成するために検証されたソフトウェアによる監査ログを含むことがあります。それは、SUVとともにキャプチャされたDICOM座標、サンプリング対象の「マスク」または各対象物の測定に使用される境界、または識別のためのROIの二次スクリーンキャプチャーです。
ccまたはccに変換できるボクセルで測定された各領域の体積も、言及された領域内の最小、最大および標準偏差とともに含めるべきです。参照組織(例えば、小脳全体または小脳灰白質、橋、皮質白質、その組み合わせ、その他)は、標的領域SUVデータとともに報告されなければなりません。識別は具体的でなければならず、灰白質、白質、または両方の組織タイプが含まれているかどうか、およびどの断面で含まれているか除外されているかを示さなければなりません。分析ソフトウェアは、明確で、追跡可能で、解釈可能なレポートを生成する必要があります。
3.5.イメージの解釈と報告
現時点では、画像解釈のためのQIBAプロファイル仕様は提供されていません。イメージの解釈は、このドキュメントの範囲を超えていると考えられます。
言いかえると、どのように定量的応答が測定されるかは、試験自体によって先験的に特定されるべきです。これは、標的病変の選択にも適用されます。
| パラメーター | エンティティ/アクター | 仕様 |
| 画像報告 | イメージング施設 | イメージングレポートは、構造化レポートを使用してDICOMヘッダー情報から取り込まれるものとする。 |
3.6.品質管理
以下のセクションでは、アミロイド-PET研究における品質管理の複数の側面について扱います。これには、PET / CTイメージング施設、イメージング要員、PET / CTスキャナー、および付帯設備の選択と認定が含まれます。加えて、データの完全性が欠如しているため、ファントムイメージング(研究開始前および進行中)の使用と、データを検閲する必要のある被験者を特定することが議論されています。最後に、画像取得後の品質評価について詳しく説明します。
3.6.1.イメージング施設
スキャナーの信頼性の高いパフォーマンスと、一貫した画像取得方法を保証する品質プロセスを実装することが不可欠です。これらのプロセスは、対象となる撮像に先立って実施されなければならず、試用期間中追跡されなければなりません。イメージングバイオマーカーとしてのアミロイド-PET / CTの使用を含む臨床試験への参加のための施設選択の前提条件は、「撮像能力評価」です。この撮像能力評価は以下を含みます。
- 試験での使用を意図した適切な撮像装置の識別
- スキャナー及び付属装置(例えば、放射性核種キャリブレータ)の要求される品質管理手順の実績の文書化
- 放射性トレーサーの品質管理手順
- 主要人員(技術者、放射線技師、物理学者、その他のイメージングエキスパート)の経験
- 試行中の撮像プロトコール適合性を保証する手順
3.6.1.1.施設認定/資格保守
撮像施設の認定は、日常的な臨床実地の目的(ACR、IAC、TJCなど)、設備資格(EARL、SNMMI-CTN、ACRIN、イメージングコアラボなど)では一般的に適切であると考えられますが、研究/臨床試験への参加が要求されるかもしれません。このプロファイルに準拠しているとみなされるためには、撮像スキャナー/施設は、現在の認定ステータスの文書を提供しなければなりません。特定の臨床試験要件によって指示されているように、進行中の品質管理手順が適時に実施されていることを確認するために、適切な書式、チェックリストまたはその他の手順文書を維持し提示する必要があります。以下に記載されている業績基準の例外が発生し、現場で修復することができない場合、サイトは適切な内部監督者にその問題を速やかに伝達し、不正をどのように管理すべきかアドバイスします。このプロファイルに必要なパフォーマンスのレベル(および達成されたパフォーマンスのレベル)を文書化することに加えて、施設認定/資格の頻度も記述する必要があります。
このプロファイルで定義されているように撮像施設の認定および/または資格認定は必要であると考えられていますが、このプロファイルに準拠するには十分ではありません。プロファイルに準拠し、プロファイルの主張を支持するためには、すべての規範的要件を満たす必要があります。
| パラメーター | エンティティ/アクター | 仕様 |
| 認定/資格 | イメージングサイト& 画像取得デバイス |
臨床実務(ACR、IAC、TJCなど)の認定ステータス、または臨床試験の認定ステータス(ACRIN、SNMMI-CTN、EARL、iCROなど)を維持、文書化します。 |
3.6.2.イメージング施設の人員
下記の各職種には、訓練、資格認定、継続教育、同僚批評基準が定義されている必要があります。 各リソースカテゴリのトレーニング/資格認定のガイドラインを以下に要約します(UPICTプロトコルセクション2.1)。PET / CTアミロイドスキャンを読んでいる医師だけが、PETアミロイドの解釈のための特別なトレーニングと証明が必要であることに注意してください。
| パラメーター | エンティティ/アクター | 仕様 |
| 人員名簿 | 撮像施設 コーディネーター |
試用開始および被験者への実施前に、各サイトは、認定された技術者、物理学者、医師(以下に定義する)は、アミロイド-PET / CTを臨床試験に使用経験があるようにしました。 |
| 技師 | 撮像施設 コーディネーター |
技術者の認定は、核医学技術者協会(SNMTS)および米国放射線技師協会(ASRT)の代表者が公表した勧告と同等でなければならず、地方、地域および国の規制があり、患者に電離放射線を投与するための要件です。 |
| 医学物理士 | 撮像施設 コーディネーター |
医学物理学者は、米国放射線医学会(ABR)による医学核物理学または放射線物理学の認定を受けなければなりません; または核医学における米国科学委員会の核医学物理学における研究(ABSNM)の認定を受けなければなりません; 核医学におけるカナダ物理学者の物理学の認定を受けなければなりません; またはその他の国では同等の認定を取得することが必要です。または過去24ヶ月間に少なくとも2回の年次施設調査を実施していることが必要です。 |
| 医師 | 撮像施設 コーディネーター |
PET / CTスキャンを監督する医師は、米国内のABR(Diagnostic and / or Nuclear Radiology)または米国原子核委員会(ABNM)または米国内の同等のもの、またはイメージング研究が行われているおよび/または解釈される地理的位置に適した同等のエンティティで認定されるべきです。医師は、アミロイド脳のPET検査(PETアミロイドトレーサに特有のもの)の解釈に適切かつ具体的な初期訓練を行い、画像検査が存在する地理的な場所に適した全国画像専門家団体によって概説された継続的な熟練を維持するべきです。 |
3.6.3アミロイドPET取得スキャナー
このプロファイルに記載されているアミロイド-PET研究は、PET / CTスキャナーまたは送信PET画像を取得する能力をもつ専用のPETスキャナーを必要とします。このプロファイルの将来のバージョンでは、PET / MRスキャナーを追加することができます。スキャナーは、製造元、名前、モデルに基づいて識別される必要があります。ハードウェア仕様を文書化する必要があります。スキャナーのソフトウェア名とバージョンは、試用開始時およびすべてのアップデートまたはアップグレード時に文書化する必要があります。
専門家および/または規制当局によって定義されるように、スキャナーは日常的に、臨床応用に適した品質保証および品質管理プロセス(予防保守スケジュールを含む)を受けなければなりません。イメージング結果の適切な定量精度および精度を保証するために、以下に説明するように、追加の品質保証手段が必要とされます。
一貫性を保つために、臨床試験の被験者は、研究の全過程にわたって同一の装置で画像化されるべきです。同じメーカーとモデルの交換用スキャナーが適切な資格を持っている場合は、それを使用することができます。ただし、トライアルスポンサーには、スキャナー交換が発生した場合に通知することが不可欠です。
定量撮像要件の臨床試験では、交換用スキャナーとの定量的同等性が明確に示されていない限り、被験者は1つのスキャナーでのみスキャンを実施する必要があります。 しかし、スキャナー間の定量的等価性を実証するための基準は現在のところ存在しないことに留意すべきです。このプロファイルの将来のバージョンでは、このような基準が提供されることが予想されます。
| パラメーター | エンティティ/アクター | 仕様 |
| 物理的検査 | 技師 | 毎日、トンネルや被験者の取り扱いシステムのガントリーカバーをチェックしてください。 |
| QA / QCチェック | 技師 | 最低限、QA / QC手順はベンダーの推奨に従って毎日実施するものとします。毎日のQC手順は、被験者スキャンの前に実施されなければなりません。 |
3.6.3.1.付属装置
3.6.3.1.1.放射性核種キャリブレーター
以下のガイドラインは、ANSI規格N42.13,2004およびIAEA技術報告書シリーズTRS-454から収集されています。 全ての要件は、単位用量のアミロイドトレーサーの測定を想定しており、その較正源は「注射器」形状(すなわち、バルク用量なし)です。
不変性試験は、既知の活性長寿源を測定することにより、長期間にわたる活性測定の再現性を保証します。
精度試験は、放射性核種キャリブレーターによって決定された活動値が、報告された不確実性の範囲内で国内基準または国際基準に適合し、追跡可能であることを保証します。
線形性試験は、個々の放射性核種について、その放射性核種キャリブレーターの使用範囲にわたって正しい活動度を得るために、同じ較正設定を適用できることを確認します。
| パラメーター | エンティティ/アクター | 仕様 |
| 不変性 | 技師 | NIST追跡可能な(または同等の)シミュレートされた18 F、Cs-137、またはCo 57放射性核種較正標準を用いて毎日(または放射性核種キャリブレーター事象後)評価し、正味測定された活動が期待値から±2.5%以下異なることを確認しなければなりません。 |
| 精度 | 技師 | NIST追跡可能な(または同等の)シミュレートされたF-18放射性核種キャリブレーター標準を用いて毎月(または任意の放射性核種キャリブレーター事象後)評価し、 正味の測定された活動が期待値から±2.5%を超えないことを確認しなければなりません。 |
| スキャナーのキャリブレーションは、NISTトレーサブル(または同等の)のシミュレートされた18Fソースオブジェクトを使用してテストします。例えば、部分的な体積の影響または他の分解能の損失を避けるのに十分な大きさの均一なシリンダーです。 | ||
| 線形性 | 技師または放射線安全役員または認定医学物理士 | 18FまたはTc-99mのいずれかを使用して毎年(または放射性核種キャリブレーター事象の後に)評価し、37-1110 MBq(1~30 mCi)の動作範囲で真値の±2.5%以内でなければなりません。そして真の値は、同じ動作範囲にわたる(ログデータに対する)線形適合によって決定されます。 |
| PET 放射線用量 |
線量計 | 投与された活動性放射線量を記録し、投与された放射性医薬品の線量構造をDICOMに記録しなければなりません。 |
3.6.3.1.2スケールおよびスタディメーター
スケールおよびスタディメーターは、設置時および毎年点検および校正を行う必要があります。
| パラメーター | エンティティ/アクター | 仕様 |
| スケール | 承認済み人員 | 毎年、または資格を有する人材による修理の後、評価を受けなければなりません。 エラーが+/- 2.5%未満であることを確認し、NISTトレーサブルまたは同等の基準を用いて期待値を算出します。 |
3.6.3.1.4時計およびタイミング装置
PET / CTスキャナーコンピューターと、活動/注入測定を記録するために使用されるイメージング施設内のすべての時計は、+/- 1分以内に標準時間基準に同期する必要があります。これらには、対象のアミロイド-PET研究、特に放射性核種キャリブレーター、注射室、スキャナー、および捕捉コンピューターに関連する時計または計時システムが含まれます。現在のQAプログラムの一環として、すべてのクロック(日付、時刻、およびタイムゾーン)の同期を定期的に監視する必要があります。特に、デイライトセービングタイム(NA)またはサマータイム(Eur)の変更や停電直後に時計を検査する必要があります。正確な同期は、IHE ITインフラストラクチャテクニカルフレームワークで定義されている一貫性のある時間統合プロファイルを使用して達成できます。一貫性のある時間プロファイルでは、Network Time Protocol(NTP)(www.NTP.org)を使用する必要があります。
| パラメーター | エンティティ/アクター | 仕様 |
| スキャナーと施設の時計 | 承認された人員 | PET / CTスキャナーコンピューター、および活動/注入測定値の記録に使用されるイメージング施設のすべての時計は、+/- 1分以内に標準時間基準に同期させなければなりません。 アミロイド-PET研究の実施に使用されるすべての時計の同期は、毎週および、デイライトセービングタイム(NA)またはサマータイム(Eur)への変更や停電後に確認されなければなりません。 |
| スキャナーと施設の時計 | 特定のデバイス | IHEの一貫性のある時間統合プロファイルに従い、時刻同期を行います。 線量計時計 線量計 線量キャリブレーターからの出力電子記録は、他の時間管理装置と同期させなければなりません。 |
3.6.4ファントム撮像
3.6.4.1均一性と較正
均一なファントムによるスキャナーの正規化の検証は、定性的なエンドポイントのみを含む臨床試験で使用されるすべてのスキャナーにとって、最低限の要件です。アミロイド測定量によって使用される完全なFOVにわたって分析のゴールドスタンダードの面内および軸方向比較を介し、スキャナーの正規化を検証するため、均一なファントムの代わりにホフマン、または同等のファントムを使用することができます。定量的PET測定の試験では、この評価には、定量精度を確保するための放射性核種較正物質との比較も含まれている必要があります。すなわち、測定された絶対量対注入量の比較が行われなければなりません。この比較は、ソフトウェアまたはハードウェアのアップグレード後に特に重要です。この試験が、ベースライン画像における絶対的定量、または縦断研究における絶対的変化を必要とする場合は、通常のQC手順および/またはスキャナーの検証プロセスの一部として、画質および/またはコントラスト回復QC評価を含めることが考慮されるべきです。縦断研究における相対的変化のみを用いた臨床試験では、部分的体積効果に基づいて標的病変の最小サイズを適切に考慮すれば、コントラスト回復評価は必要ないかもしれません。
画像から定量的データを抽出するために必須の要件は、(局所的に)使用される放射性核種較正物質(10%以内)に対するPETシステムの較正の正確度および精密度、および/または交差較正が既知であることです。QC手順は、対象スキャンに使用されるものと同じ取得/再構成プロトコール、ソフトウェア、および設定を利用する必要があります。
| パラメーター | エンティティ/アクター | 仕様 |
| ファントム試験:均一性測定の頻度 | 撮像施設 | ベースライン時、四半期、およびスキャナーのアップグレード、保守または修理、および新しい設定後に実行します。 |
| 均一性管理 | 技師 | 少なくとも四半期ごとにソフトウェアをアップグレードした後、均一な円筒ファントムを撮像することにより、画像平面にわたる横方向および軸方向の均一性を評価しなければならなりません。 1.ストリークアーチファクトまたはアキシャル面の不均一性がないことを視覚的にチェックします。 2.大きな中央2D ROIの標準偏差は、類似の以前のスキャンと比較して、測定可能な差異をチェックします。 3.すべての画像スライスの大きな中央2D ROIの平均値は、類似の以前のスキャンと比較して、測定可能な差異をチェックします。 |
| ファントムテスト:軸方向均一性測定 | 撮像施設 | NEMA NU2 1994に規定されているように、(面内の)軸方向の均一性を測定しなければなりません。各軸方向スライス(以下を参照)ごとに10%未満の均一性が必要です。 |
| NEMA NU2 1994に規定されているように、(面内の)軸方向の均一性を測定しなければならなりません。各軸方向スライス(下記を参照)ごとに5%未満の均一性が必要です。 | ||
| ファントム試験:軸方向均一性測定 | 撮像施設 | 円筒面ファントムの有効直径よりも小さい、少なくとも1cmの円形ROIを各軸平面の中心に配置することによって、軸方向の均一性を測定しなければなりません。各ROIのCOV(標準偏差/平均* 100)を計算します。COVが10%未満のアキシャル平面は、使用に適しています(例:端面の一部が対象外となる場合があります)。 |
| COVが5%未満の軸平面を使用する場合を除いて、上記と同じ手順を用いて軸方向の均一性を測定しなければなりません。 | ||
| 調和画像再構成プロトコールが利用可能です。(すなわち、修正されたNEMA NU-2画像品質ファントムのような所与の試験対象についての既知の回復係数対サイズ)。 |
3.6.4.2解像度
適切な解像度の評価には、定性的評価(臨床的または擬人的なファントム画像を使用)と定量的評価(ファントム定義の基準を使用)の両方が含まれるべきです。
| パラメーター | エンティティ/アクター | 仕様 |
| 解像度 | 核医学医師 | メーカーの設定を使用し、脳の臨床画像内の正常な総体的解剖学的特徴の解明を実証することにより、少なくとも年1回は実行し、定性的分解能QC試験を文書化します。 |
| 解像度 | 医学物理士 | ホフマン、ACR、またはNEMA IQファントムなどの異なるサイズの規定されたファントムを使用し、空間的分解能について定量的評価のパフォーマンスを文書化します(初期のサイト認定プロセス中に、少なくとも1年に1回)。 |
| Lodge et al[JNM 2009; 50:1307-1314]によって開発された変更手順に従い、わずかに傾斜した均一ファントムを使用して、軸方向および面内空間分解能を得ます。 |
3.6.4.3ノイズ
| パラメーター | エンティティ/アクター | 仕様 |
| ファントムテスト:ノイズ測定の頻度 | 撮像施設 | ベースライン時、四半期、およびスキャナーのアップグレード、保守または修理、および新しい設定後に実行します。 |
| ファントムテスト:ノイズ測定 | 医学物理士 | 均一な円筒ファントムまたは等価物は、均一領域(約0.1~0.2μC / ml)中の18-F濃度で満たされ、目的とする取得プロトコールを用いてスキャンされなければなりません。可能な限り矩形または球状の領域を使用して、側面に3cm以上で、領域内のボクセル値のCOVは、アキシャルFOVの中央の80%内のスライスの場合、15%未満でなければなりません。 |
3.6.4.3アミロイド-PET特異的ファントム測定
上記のPETスキャナーのより一般的なファントム評価は、臨床診療または臨床試験に適格にするために必要です。しかし、人間の脳、アミロイド取り込みパターン、およびアミロイドSUVR測定値をシミュレートするために、より多くの目的に特有のファントムも必要です。プロトコールごとに考慮される目的別ファントム・オプションには、次のものが含まれますが、これらに限定されません。
- 各サイトは、試験期間中に単一のファントムを使用しますが、必ずしも他のサイトで使用されているファントムと同じモデルである必要はありません。
- すべてのサイトでは、試験期間中、同じモデルのファントムを使用します。
- すべてのサイトでは、試験期間中、正確な仕様に基づいて作成されたファントムを使用します。
- すべてのサイトは、試験期間中、単一のファントムを共有します。
ファントムスキャンおよび性能評価は、試験の開始前に実施し、個々のプロトコールで指定された試験の経過中に繰り返さなければなりません。ハードウェアまたはソフトウェアのスキャナー機器の変更は、ただちにトライアルスポンサーおよび/またはイメージングCROに報告し、追加の試験対象をイメージングする前に再認定の必要が生じる可能性があります。特に、縦断研究の被験者は、同じソフトウェアバージョンを使用し、同じPETシステム上で可能な限りスキャンすることが強く推奨されます。
一般に、目的別ファントムスキャンは、これらのイメージング特性を特徴付けるための基準を提供しなければならなりません。
- 空間分解能 - PETスキャナーのハードウェア、再構成方法、および再構成パラメーターの選択は、再構成された画像において劇的に異なる空間分解能をもたらす可能性があります。部分容積効果(特に灰白質領域と白質領域の間)は多くのアミロイドPET測定値を偏らせることがあるので、患者撮像のために計画された取得および再構成プロトコールを用いて各スキャナーの空間分解能を較正することが不可欠です。その後、スキャナー間の均一な空間分解能で測定量を計算するために、再構成後の平滑化演算を適用することができます。
- 均一性 - アミロイドPET測定値の計算に使用するスキャナーの視野全体で、目的別ファントムの面内および軸方向の均一性は10%以内でなければなりません。
- 再構成アーチファクトの欠如 - 再構成された目的別ファントムデータは、欠陥検出器によるストリークや、正規化誤差による軸平面不均一などの再構成アーチファクトを視覚的になくさなければいけません。
- 定性的および定量的精度 - SUVRなどの比率を使用する測定値は、分析上または既知のゴールドスタンダードの10%で精度を示す必要があります。
理想的には皮質灰白質に類似した空間分布を有する擬人化ファントム(例えば、3Dホフマンファントムまたは等価物)は、上に列挙した5つのイメージング特性を特徴付けるために必要とされます。均一なファントムまたは点光源ファントムそれ自体は、PETスキャナーのアミロイド撮像特性を十分に特徴付けるには不十分です。ファントムは、減衰補正および散乱補正の効果をモデル化し、特徴付けるのに適しているはずです。アミロイドトレーサー摂取の対比率は、正常被験者と異常被験者、および異なるアミロイドトレーサー間で異なります。しかしながら、最も高い取り込み領域における活性濃度が、アミロイド沈着を有する被験者で予想される白質の取り込みと類似するように、ファントムを充填することが推奨されます。ホフマンファントムについては、ファントムの灰白質領域で約15kBq / mlの活性を得るために、スキャンの開始時の活性を0.5-0.6mCi(18.5-22.2MBq)にすることが推奨されます。このファントムのベストプラクティスのガイダンスについては、付録Hを参照してください。
ホフマンファントムは、PETスキャナーのFOVの中心に置き、データを20分間取得する必要があります。さらに、画像再構成方法および設定は、研究で指定されたものと等しくなければなりません。後処理およびデータ解析は、患者データで使用されるものとできるだけ類似している必要があります。いずれの被験体も試験でスキャンされる前、およびこれらの特性に影響を与える可能性があるソフトウェア修正の主要ハードウェアの後に、スキャナーイメージング特性のベースライン評価が必要です。ホフマンファントムを使用したベースラインの資格評価に続いて、より単純なファントムを使用するルーチン製造業者が推奨するQA手順(例えば、毎日のQCチェック、四半期の正規化など)は、臨床試験の過程で許容できるスキャナー性能を実証するのに適しています。長期的な研究では、少なくとも年1回はベースラインの資格評価が必要です。
以下の規範的なリストは、ホフマン擬人化、NEMA画質、ACR、および均一な円筒ファントムに基づいています。
| パラメーター | エンティティ/アクター 仕様 | ファントム・テスト:ホフマン・ファントム・データに基づく測定の頻度 撮像施設 最初のベースラインの特徴付けとして、その後は毎年、また主要なスキャナーのアップグレード、保守または修理後に必要とされます。 |
| ファントムテスト:分解能測定 | 撮像施設 | ホフマンファントムを使用してデータを取得し、横方向および軸方向のFWHM分解能を計算します。FWHM「ホフマンと同じ」[Joshi / Koeppe NeuroImage 46(2009)154-159]。分解能は8.0 mm FWHM以下でなければなりません。 |
| ファントムテスト:灰白質/白質の比率測定 | 撮像施設 | ファントムのデジタル表現にホフマンのファントムPET画像を登録し、灰白質/白質の物質比を計算します。この比率は>0.55でなければなりません。詳細は、付録Iを参照してください。 |
| ファントムテスト:SUVRの精度 | 撮像施設 | ホフマンファントムPET画像を使用して、SUVR精度を確認するために同じ後処理および画像解析を実行します。詳細は、付録Iを参照してください。 |
3.6.4.4ファントムイメージングデータ分析
アミロイド-PET画像分析には、使用されるハードウェアとソフトウェアの組み合わせが多数存在します。ソフトウェア単独で、オペレーティングシステム、入力と表示のためのいくつかの基本モジュール、ROIを描画/計算してSUVRを計算する成分を含む複数の層から構成されています。セクション4.4と付録Fを参照してください。
3.6.5アミロイド-PET研究の品質管理
3.6.5.1データの完全性
DICOMイメージヘッダーの完全性は、DICOM標準の準拠、法令遵守(該当する場合はHIPAAプライバシー規則などの規則によって要求されるようなプライバシー保護を含む)、プロトコルコンプライアンス、意図された分析のための十分性(例: SUVを計算するため)、およびCRFなどのソースデータとの一貫性を確認する必要があります。
3.6.5.2 画質の決定
画質評価および、線質硬化、金属物、動きなどの潜在的なアーチファクトについて、画像解析者がCTおよび68-Geトランスミッション画像(透過画像またはトランスミッション画像に統一を)を検討しなければなりません。適切な画像位置合わせや潜在的減衰補正アーチファクトのため、PET画像は透過画像と比較されなければなりません。造影剤や金属インプラントおよび/または被験者の動きによって引き起こされるアーチファクトを識別するため、減衰補正画像と補正されていない画像のいずれも評価する必要があるかもしれません。例えば体動や位置合わせのミスは、質の悪い定量データや無効な数字となる可能性があります。一部の画像は質が悪いため定量できないこともあります。統計的画質は報告すべき重要なことですが、画質の完全な代わりにはなりません。
3.6.5.3 アミロイドPET解析に不適な被験者の決定
3.6.6 解釈の品質管理
解釈の質管理のために定量可能な実施基準を向上するには、読影者内の変動研究が必要です。2リーダーパラダイムではリーダー間の変動性も必要です。評価すべき統計や、どのように性能測定基準を分析に使用するべきなのかは現時点で不明です。
4.準拠手順
このプロファイルとQIBAプロファイル準拠への期待
定義(付録Cより)
資格:イメージングサイトは適切な機関(例えばACRIN、CQIE、SNM-CTN、EANM-EARL、イメージング研究室やCROなど)によって、特定の臨床研究のために正式に承認されています。
認定:独立団体、またはグループによる広範な臨床使用の承認(進行中のQA/QCを必要とする)。例えばACR、IAC、TJCなど。
準拠:イメージングサイト、および機器はQIBAプロファイルの要求を満たすのに必要な、ここに記載されている全要件を満たしています。
ここに含まれる要件は機能のベースラインレベルを確立することを目的としています。より高いレベルの性能や高度な機能を提供することが可能であり、推奨されています。さらにQIBAプロファイルは、機器供給者が要件をどのように満たすのか制限するものではありません。記載された基準を満たす機関はQIBA準拠者と見なされます。
4.1.パフォーマンスの評価:イメージ取得サイト
典型的には、臨床部位は神経学における適性や検討中の十分な被験集団へのアクセスによって選択されます。イメージングサイトでは以下の可用性を確保することが重要となります。
- 適切な撮像装置と品質管理プロセス
- 適切な補助装置、放射性トレーサー、および造影剤の利用
- CTとPETで被験者の取り扱い、および撮像手順の経験豊富な技師
- 画像解析および診断的解釈について適切に訓練された放射線科医および核医学医
- 放射線科医または核医学医の監督下で適切に訓練された画像解析者
- 適切なスキャナーと装置キャリブレーションが可能な医療物理学士
- 適切な時間域でイメージングQIBAプロファイルに準拠した画像作成を保証するプロセス
臨床試験の目的を達成するためにはPETスキャナーと補助装置のためQA/QCプログラムが必要です。最低限の要件は上記の通りです。このプログラムには(a)イメージング施設がイメージング研究を正確に実施していることを検証する要素、(b)指定された較正値で施設のPETスキャナーが実施していることを検証する要素があります。これらは放射線線量、画質(水較正、均一性、ノイズ、水平断空間分解能、再構成されたスライス厚のZ軸分解能、コントラストスケールなどに関連した問題を含む)、不変性に関連する問題を処理するPETおよびCTファントムテストと関係します。いくつかの性能テスト(例えば一定のファントム)が価値を付加することについては意見が一致しています。しかし許容可能な性能レベル、性能頻度、行動の誘因や緩和戦略はこれらが必要となる前に定義する必要があります。臨床試験の目標に特有の性能を評価するため、装置の製造者が定義したQAプログラムに加えて、このファントムテストが実施されることがあります。
| パラメーター | エンティティ/アクター | 仕様 |
| PET スキャナー |
取得施設 | このプロファイルは、減衰補正のための透過画像取得能を有し、シングルベッドの位置に対して15cmの最小水平軸FOVを有するフルリングPETスキャナーのみ扱うものとします。 |
| CT スキャナー キャリブレーション |
技師 | 水等価ファントム分析を毎日実施します;出力が許容できるかを確認し、手動でフォーム/電子データベースに入力するようにします。 |
| PET スキャナー キャリブレーション |
技師 | スキャナーQAおよび業者の推奨する整備手順(例えば、専用PETスキャナーの弱い送信源の交換)を毎日/毎週/毎月実施します;出力値が許容できるかを確認し、手動でフォーム/電子データベースに記入します。 |
| PET スキャナー キャリブレーションの安定性チェック |
技師 | 安定性ファントム(例えばGe-68円筒)スキャン(均一性に関する情報を収集するためにもNISTトレーサブルもしくは同等のものが好ましい)を少なくとも毎週、および各キャリブレーション後に実施します。 |
| 放射性核種キャリブレーター | サイトやキャリブレーター製造者によってNISTトレーサブル源や同等の物を使用して、18Fまでキャリブレーションされたものとします。 |
4.2 パフォーマンス評価:PET取得装置
このセクションでは、セクション4.1に記載されたイメージング施設で取得装置の品質管理に適用される性能仕様および試験頻度とは異なり、製造施設から出荷時に満たす取得装置の性能仕様を定義します。モバイル機器、あるいは固定設備であっても、このプロファイルに適合するために取得機器は同じ規格にならなければなりません。この性能を満たすため、モバイルスキャナーに追加のキャリブレーションが必要となるかもしれません。
PETスキャナーはDICOM属性を使用して1取得、2再構成、3後処理、4表示/ROI解析、5動的解析のソフトウェアバージョンをたどる必要があります。ソフトウェアバージョンの識別、文書化、時間のトラッキングに関する性能要件はセクション4.5で記述します。
PETスキャン取得の開始時間は減衰基準時間に使われ、積分モデルは減衰補正に使われる必要があります。スキャナー(すなわち、操作者ではない)は、全減衰補正を実施しなければなりません。画像データはBq/ml単位で表示するものとします。「派生」画像(「オリジナル」とは区別する)はDICOM基準に従ってフラグをつけ、スキャン取得データと日時フィールドを保持する必要があります。
完全に補正された投与放射能(例えば残留放射能、注射時間、キャリブレーション時間)に必要となった情報はすべて必要となります。下記の残留放射能という用語は、完全に補正された正味放射能を指していることに留意してください。
ベースラインレベルの適合性は、被験者のPETスキャン、(現在、全PETスキャナー取得プロセスによって保存されていない)必要なメタデータからのDICOM画像が症例報告などの試験文書に取り込まれることを必要とします。メタデータは定量分析を行い、SUV共変量の品質管理を行うために必要です。これは、例えば注入後の残留放射能、および被検者の身長などを含みます。付録Eに記載されているように、「Common Data Format Mechanism」でこのデータを取り込む必要があります。
PETスキャナーで使用されるDICOM形式は、PETシステムの製造元が作成した適合性説明書を満たす必要があります。PETデータは、DICOM PET、あるいはEnhanced PET Image Storage SOP Classに暗号化され、公開DICOMフィールドに追加パラメーター(例えば、高さ、重さ、スケール因子)と放射能活性単位(Bq/ml)で設定して、SUVを計算します。CTデータはCTあるいは造影CT画像保存SOP Classで暗号化されます。DICOMデータはDICOM Part 8ネットワークプロトコルを使用して、あるいはCDやDVDを含むメディアストレージ用のオフラインDICOM Part 10ファイルとして転送されます。それらは損失のある圧縮型をとらずに転送されるものとします。
メタ情報はPET SUVの定量的に正確な表示に必要とされる(Bq/ml単位の)画像値とは別個、あるいは付加的な情報です。メタ情報にはSUV計算に必要な範囲を超えた情報、つまり治療のタイプおよび/または順序、血糖値、スキャナーSUVの安定性履歴などを含むこともあります。情報を取り込むメカニズムに関してはこのプロファイルでは指定されていません。ここでの目的はメカニズムそのものではなく、どの情報を取り込むべきかをリスト化することです。このメカニズムは、紙メモからスキャンされた形態や電子データ記録、測定装置からあらかじめ指定されたDICOMフィールド(つまりPETスキャナーあるは放射性核種較正などの補助測定装置)への直接登録まで及びます。理想的には全ての指定されたメタデータは、PETイメージング用のDICOMフォーマットを適切に修正した後、DICOMフィールドへ直接電子入力によって取り込まれます。
いくつかの施設ワークフローでは、取得装置がワークステーション/分析ツール機能を提供することがあります。例えば、このように使用される場合、(セクション4.4.1で考察した)SUV統計または、(セクション4.4で考察した)トレーサー取込時間の表示が、取得装置にも適用される可能性があります。
ここで推奨されている概念は、必要なメタデータが特定されているということです。このプロファイル、DICOMの基準、技術の改定を通じて、メタデータはより直接的な方法によって分析ストリーム(図3)に挿入され、承認された基準は発展していきます。
| パラメーター | エンティティ/アクター | 仕様 |
| CT キャリブレーショントラッキング |
取得装置 | DICOMヘッダーで毎日の水等価ファントム値は追跡されるものとします。 |
| PET キャリブレーション係数 |
取得装置 | 現在のSUVキャリブレーション係数はDICOMヘッダーに含まれるものとします。 |
| PET QA ステータス |
取得装置 | システム全体のQAチェック日時/時刻およびステータスは、個別に取得されるものとします。 |
| 放射性核種キャリブレーター較正 | 取得装置 | DICOMヘッダーでF-18 NISTトレース可能な(または同等の)供給源のキャリブレーション係数を識別情報とともに日付/時間で追跡するものとします。 |
| PET スキャナー キャリブレーション |
取得装置 | 次の仕様に従って較正されるものとします。 ・水中でF-18を含むACR型の均一なシリンダー(理想的には線量キャリブレーターのクロスキャリブレーションに使用されるものと同じ)を使用します。 ・(ノイズを最小限にするため)60分以上の長時間スキャン、およびACRタイプのROI分析を使用します。 測定された平均SUVは0.98-1.02の範囲内でなければなりません。(これはこのセクションの前文で説明した通り、臨床画像操作中に期待される性能ではないことに注意してください)。 スライス間変動は±5%以内でなければなりません。(ACRPET Core Lab毎のように最終スライスは含みません)。 上記ファントムの面内均一性は5%未満とします。 |
| 体重 | 取得装置 | モダリティワークリスト、および/またはスキャナーインターフェイスへのオペレータ登録から与えられた患者体重をlbs、またはkgで記録することができるものとします。DICOM基準に従い、DICOMイメージヘッダーの患者体重フィールド(0010,1030)に保存されます。 患者体重は4桁の有効数字で指定されるものとします。 患者体重は電子、HIS/RIS、または他の方法によって測定装置からスキャナーに直接転送でき、操作者の入力を回避できますが、操作者の修正も可能です。 |
| 身長 | 取得装置 | モダリティワークリスト、および/またはスキャナーインターフェイスへのオペレータ登録から与えられた患者身長をfeet/inch、またはcm/mで記録することができるものとします。DICOM基準に従い、DICOMイメージヘッダーの患者サイズフィールド(0010,1020)に保存されます。 患者身長は3桁の有効数字で指定でされるものとします。 患者身長は電子、HIS/RIS、または他の方法によって測定装置からスキャナーに直接転送でき、操作者の入力を回避できますが、操作者の修正も可能です。 |
| 投与された放射性核種 | 取得装置 | 局所的に構成可能な値テーブルを介してRequested Procedure Codeから導出することにより、DICOMモダリティワークリスト、存在する場合はNM/PETプロトコルコンテクストから放射性核種タイプ(すなわちF-18)を受け入れることができるものとします。 スキャナーインターフェイスへのオペレータ登録によって放射性核種タイプ(すなわち、F-18)を登録できるものとします。 DICOM画像ヘッダーのRadionuclide Code Sequence(0054,0300)に記録されます。(例えば、(C-111A1,SRT,” 18Fluorine”)。 操作者の修正も可能ですが、操作者の入力を回避したSup159放射性医薬品投与線量レポートを使用し、測定装置(投与量キャリブレータ)、あるいは管理システムから直接に放射性核種タイプ(すなわちF-18)を受け入れることができるものとします。 |
| 投与された放射性トレーサー | 取得装置 | スキャナインターフェイスへのオペレータ登録から与えられた特定の放射性トレーサーを記録できるものとします。DICOMヘッダーのRadionuclide Code Sequence field(0054.0300)に記されます。例えば(C-B1031,SRT,”Fluorodeoxyglucose F18”)。 |
| 投与された放射性トレーサーの放射能 | 取得装置 | スキャナーインターフェイスへのオペレータ登録から与えられた通りにMBqおよびmCiの両方で、投与された放射能を入力することができます。DICOM画像ヘッダーのRadionuclide Total Dose fields(0018,1074)にBqで記録されます。 スキャナーインターフェイス上の別々の入力フィールドで記録できるものとします: (1) 注射前18F-アミロイドトレーサーの放射能 (2) 注射前18F-アミロイドトレーサー放射能の測定時間 (3) 注射後の残留放射能 (4) 注射後の残留放射能の測定時間 投与された放射能を自動的に計算し、DICOMヘッダーのRadionuclide Total Dose field(0018,1074)に保存します。 あるいはDICOM付録159に従ってこの情報を受け取ることができるものとします。 患者に投与された放射性トレーサーの放射能情報は電子、HIS/RIS、または他の方法によって測定装置からスキャナーに直接転送でき、操作者の入力を回避できますが、操作者の修正も可能です。 |
| 投与された放射性トレーサー時間 | 取得装置 | スキャナーインタフェースへの操作者の登録から与えられた通りに注射開始時刻を記録できるものとします。Radiopharmaceutical Start Date Time field(0018,1078)(好ましい)、またはRadiopharmaceutical Start Time field(0018,1072)に記録されます。 スキャナーインタフェースへの操作者の登録から与えられた通りに放射能注射の開始時刻を記録できること。Radiopharmaceutical Start Date Time field(0018,1078)に記録されます。すなわち、Radiopharmaceutical Start Time field(0018,1072)ではありません。 スキャナーインタフェースへの操作者の登録から与えられた通りに注射終了時間を記録できるものとします。Radiopharmaceutical Stop Date Time field(0018,1079)に記録されます。 |
| 減衰補正方法論 | 取得装置 | Rescale Slope field(0028,1053)で適用された符号化ボクセル値は、(ベッドの位置に関わらず)最初の取得開始時間である単一の参照時間まで、(オペレータではなく)スキャナーソフトウェアによって減衰補正されます。オリジナル画像の場合は、Series Time field(0008,0031)で符号化されるものとします。 |
| スキャン ワークフロー |
取得装置 | プロファイルプロトコル(セクション3)PETおよびCT取得オーダーを維持できるものとします。 患者取得のためのプロファイル取得プロトコールを(画像部位で)保存し、事前規定できるものとします。 取得プロトコールを再作成できるよう、以前に再構成された患者画像を解釈できるものとします。 (独自の、または標準フォーマットで)事前規定されたプロトコールとして取得パラメーターを保存(または受信)するように設定可能とし、保存されたプロトコールを再利用して、多施設の仕様を満たし、同じ被験者に対して時間帯全体にわたり反復可能な性能を達成できるようにします。 |
| CT獲得パラメーター | 取得装置 | 標準DICOMフィールドを使用し、CT画像ヘッダー内のすべての重要取得パラメーターを記録します。 DICOM画像ヘッダーの実際のFOV、スキャン時間、スキャン面、全照準幅、単一照準幅、スキャンピッチ、管電位、管電流、回転時間、露光およびスライス幅を含みますが、これらに限定されません。 |
| CTベースの減衰補正 | 取得装置 | CT画像の補正(減衰、散乱など)に使用された情報を、PET DICOM画像ヘッダーに記録します。 |
| PET-CT整列 | 取得装置 | PETとCT画像を任意の方向に±2mmの範囲で同調できるものとします。 最大荷重がかかった状態で、co-scan長にわたってPETとCT画像を±2mm以内の任意の方向に同調できるものとします。 |
| CT吸収放射線量 | 取得装置 | 吸収線量(CTDI、DLP)をDICOM放射線線量構造化レポートに記録します。 |
| 再構成画像での放射能濃度 | 取得装置 | Bq/ml単位で画像データを保存し、記録(変更)でき、Units field(0054,1001)にBQML値を使用できるものとします。 |
| トレーサー取り込み時間 | 取得装置 | Radiopharmaceutical Start Date Time field(0018,1078)(好ましい)、またはRadiopharmaceutical Start Time field(0018,1072)、およびSeries Time field(0008,0031)、または最も早いAcquisition Time Field(0008,0032)(すなわち、第1のベッド位置での取得開始)との差から導かれ、これはSeries Time field(0008,0031)として報告されるべきです。 |
| PETボクセルサイズ | 取得装置 | 再構成ソフトウェアの仕様要件下でセクション4.3(PETボクセルサイズ)を参照してください。 |
| CTボクセルサイズ | 取得装置 | 再構成されたPETボクセルサイズ以下であるものとします。 ボクセルは正方形でなければなりませんが、Z(頭-足)軸において等方性である必要はありません。 再構成されたPETボクセルサイズと同じである必要はありません。 |
| 被験者の配置 | 取得装置 | Patient Orientation Code Sequence field(0054,0410)(腹臥位または仰臥位のいずれか)、およびPatient Gantry Relationship Code field(0054,0414)(頭部または足部のいずれが先か)に被験者の位置を記録できるものとします。 |
| 走査方向 | 取得装置 | 走査方向(頭尾側か尾頭側か)を適切なDICOMフィールドに記録できるものとします。 |
| 試験詳細の文書化 | 取得装置 | Field of View Dimensions(0018,1149)で取得し、Reconstruction Diameter(0018,1100)で再構築したx-y軸FOVを記録し、規定できるものとします。 規定された目印部位(例えば、頭頂、EAM)からの距離に基づいて、解剖学的範囲を規定できるものとします。(目印位置(解剖学的に)、及び目印からスキャンされた距離の両方にはDICOMタグが必要です)。 将来のスキャンセッションで報告できるようにします。 取得装置は、スキャン解剖学的カバレッジの実際の距離(cm)を表すz軸FOVを記録するものとします。 |
| 微分取得時間 | 取得装置 | 臨床的な関心領域に応じて、不均一なスキャン時間を取得し、記録できるものとします。記録はActual Frame Duration(0018,1242)およびFrame Reference Time(0054,1300)を使用して行うことができます。 |
| DICOMコンプライアンス | 取得装置 | PETスキャナーのDICOM適合性説明書に従い、適切なDICOMフィールドを使用して全画像データおよびスキャンパラメータを転送可能にします。 |
| DICOMデータ転送および保存フォーマット | PETスキャナーあるいはディスプレイワークステーション | 公開DICOMフィールドに保存されたSUV計算を可能にするための追加パラメーターと放射能濃度単位(Bq/ml)を用いて、PET画像はDICOMPETまたはEnhanced PET画像保存SOP Classにコード化されます。 PET画像は転送され、非可逆圧縮でない形式で保存されなければならなりません。 |
| パラメーター | エンティティ/アクター | 仕様 |
| DICOM編集 | 取得装置 | スキャナーからの画像配信前にSUV計算に関連する全てのフィールドを編集できるものとします。最優先の現在値が開始された場合に、適切な警告を与えます。 |
4.3.パフォーマンス評価:ソフトウェアの再構成
再構成ソフトウェアは以前の対象処理および画像取得段階で得られた情報を伝え、再構成セクションに記載されている項目で拡張するものとします。
| パラメーター | エンティティ/アクター | 仕様 |
| メタデータ | 再構成ソフトウェア | 前の段階で収集された情報を正確に広め、再構成セクションに記載されている項目を使用し、その情報を拡張できるものとします。 |
データは定量化に必要な全補正を含み、散乱や減衰補正なしに再構成されます。分析または反復再構成法は適用される必要があります。もしこのシステムが解像度の回復および/またはTime-of-Flight法を提供できる場合、将来的には特定のプロトコール通りにこの機能のオン/オフ決定がされ、複数時点で与えられた被験者で一貫していなければなりません。
再構成設定の標準化は、同一被験者および被験者内の部位で同等の分解能やSUV回復を得るために必要です。
| パラメーター | エンティティ/アクター | 仕様 |
| データ補正 | 再構成ソフトウェア | PET放射データは、幾何学的反応および検出器効率、システムの不感時間、ランダムな同時性、散乱、減衰のために補正できなければならないです。 |
| 再構成方法論 | 再構成ソフトウェア | 反復および/または分析(例えばフィルタ補正された逆投影)再構成アルゴリズムを提供できるものとします。 画像再構成にTOF及び解像度回復のいずれかが使用されている場合、TOFと解像度回復の両方について指示できるものとします。 |
| 再構成方法論/出力 | 再構成ソフトウェア | 減衰補正の有無に関わらず、再構成を実行できるものとします。 |
| データ再構成 2D/3D互換性 |
再構成ソフトウェア | 3D画像再構成アルゴリズムを使用し、3Dモードで取得されたデータの再構築を実行できるものとします。 3Dモードのデータを2Dモードに再変更できる場合、2D画像再構成アルゴリズムを使用して3Dモードで取得したデータの再構成を実行できるものとします。 |
| 定量キャリブレーション | 再構成ソフトウェア | 全画像が放射能濃度の単位、例えばkBq/mL、を有するよう、適切な定量的キャリブレーション係数を適用します。 |
| ボクセルサイズ | 再構成ソフトウェア | 再構成FOVのマトリックス面積および/または径を調整し、利用者が画像ボクセルサイズを規定できるようにします。 (Voxel Spacing field(0028,0030)に記録され、連続スライスの画像位置(患者)(0020,0032)値間の再構成間隔から計算されたように)長軸断方向に2.5mm以下、また軸方向に2.5mm以下のサイズで、PETボクセルを再構成できるものとします。 ピクセルは正方形でなければならないですが、ボクセルはz(頭 -足)軸において等方性である必要はありません。 (Voxel Spacing field(0028,0030)に記録され、連続スライスの画像位置(患者)(0020,0032)値間の再構成間隔から計算されたように)3次元すべてで2mm以下のサイズのPETボクセルを再構成できるものとします。 ボクセルは等方性とします。 |
| 再構成パラメーター | 再構成ソフトウェア | 例えば反復数、再構成後フィルタなどの再構成パラメーターを調整することによって、利用者が画像ノイズおよび空間分解能を管理できるようにします。 DICOMワーキンググループによって開発されたEnhanced PET IODを使用し、画像DICOMヘッダーで使われた再構成パラメーターを記録できるようにします。 |
| 再構成プロトコール | 再構成ソフトウェア | 再構成パラメーターのセットを保存し、必要に応じて(手動介入なしで)将来の研究に自動的に適用できるようにします。 |
4.4. パフォーマンス評価:画像分析のワークステーション
現在画像分析ワークステーションの整合性を評価できる市販ツールはありません。Hoffmann brain DROバージョンは研究室で必要な作業のいくつかを実行するために使用されていますが、このプロファイルで定義されている全要件をこのDROで評価することはできません。
1人の患者のMRIスキャンから得られた合成PET volumesのDROシリーズは、the image analysis workstation(IAW)の整合性の評価に使用されます。ターゲット領域、およびリファレンス領域の両方に対するVOI配置の正確な実現、SUVR計算、標準化されたアトラス(該当する場合)に対するPET同調、システム直線性、システム再現性を正しく検討するために、ユーザーはこのDROシリーズを(付録FのDROユーザーガイドに従って)使用する必要があります。
| パラメーター | エンティティ/アクター | 仕様 |
| 性能評価 | 画像分析者と分析ワークステーション | 付録Fに記載されているように適切な性能を検証するためにDROシリーズを使用し、このプロファイルに準拠した試験結果を保存します。 |
| 再現性 | 画像分析ワークステーション | 2.6%以下の被験者内CVで再現性を達成することが検証されます。付録Fを参照してください。 |
| 画像分析者 | 画像分析ワークステーションツールが測定を実行するためにオペレータとのやり取りが必要な場合は、被験者内CVで2.6%以下の再現性を達成することが検証されます。付録Fを参照してください。 | |
| 直線性 | 画像分析ワークステーション | 達成することが検証されます: ・スロープ(A1) 0.95-1.05の間 ・ R二乗(R^2)>0.90 付録Fを参照してください。 |
スキャナーワークステーションに不可欠な、または第三業者が提供する後処理ソフトウェアは、セクション3.2.2、画像データ処理後で指定された操作を実行する能力があるものとします。
| パラメーター | エンティティ/アクター | 仕様 |
| メタデータ | 画像後処理ワークステーション | 前の段階で収集された情報を正確に伝え、画像分析ワークステーションの項に記載されている項目を使用し拡張できるものとします。 |
| SUVRに影響する全ての情報を計算で直接的(例えば関心領域強度)、または間接的に(画像獲得パラメーター)いずれかで表示できるものとします。 | ||
| 画像取得パラメーター:ディスプレイ | 画像後処理ワークステーション | (セクション4.2で記載した導出ガイドラインに従って)注入と画像開始の間の分数および、画像が複数の時間枠からなる場合の各時間枠の持続時間を表示するリンクを表示、または含めることができるものとします。 |
画像再構成の一部として実行されたかどうかに関わらず、画像後処理ワークステーションは以下の操作を可能にします。
| パラメーター | エンティティ/アクター | 仕様 |
| 減衰補正 | イメージ後処理ワークステーション | 再構成中に実施されなければ、画像減衰補正を可能にします。必要に応じてthe Acquisition Time field(0008,0032)またはRadiopharmaceutical Start Time(0018,1072)のいずれかを使用します。シリーズ(派生かどうか)が取得時間減衰補正に基づく場合、もっとも早いAcquisition Time(0008,0032)が減衰補正の基準時間として使用されます。 |
| 画像の向き | イメージ後処理ワークステーション | 利用者にプロトコール毎にx、y、z方向へ画像を方向付けることができます。 |
| イントラスキャン、フレーム間アライメント | イメージ後処理ワークステーション | 取得された可能性のある異なる時間枠を自動的に空間的に整列させることができるものとします。 |
| イントラスキャン、フレーム間アライメント | イメージ後処理ワークステーション | 他のフレームが並んでいるアンカーフレームを選択できるようにします。 |
| イントラスキャン、フレーム間アライメント | イメージ後処理ワークステーション | 各フレームを基準フレームに合わせるために必要な並進および回転パラメーターを測定し、表示します。 |
| 静止画像の作成 | イメージ後処理ワークステーション | フレームの平均化、または合算から作成された静止画像から一つ以上のフレームを除くことを可能にします。 |
| 静止画像の作成 | イメージ後処理ワークステーション | 分析用の静止画像を作成するために選択された時間枠を合算および/または平均することができるものとします。 |
| 平滑化 | イメージ後処理ワークステーション | 研究プロトコールの一部として指示されている場合、3D平滑化フィルタを適用できるものとします。 |
| データ保存と転送 | イメージ後処理ワークステーション | 画像操作の各主要段階の後(例えばフレーム合算後)に画像を保存できるものとします。 |
分析ワークステーションに求められる機能は、PETスキャンの関心領域および参照領域の定義や適用のために選ばれた方法に一部依存します。フルダイナミックスキャン、部分ボリューム補正、関心領域を作成するためMRIセグメンテーションなどの動力学モデリングといった特定の追加機能も研究プロトコール毎に関連しますが、それらの説明はこの文書の範疇を超えています。
| パラメーター | エンティティ/アクター | 仕様 |
| 画質管理:目視検査 | 画像分析ワークステーション | 横断、矢状断、冠状断視野の全画像スライスが視覚的に検査される方法で、各画像を表示できるものとします。 |
| 空間マッピング:画像融合(共同登録) | 画像分析ワークステーション | この取り組みが実施された場合、PET画像と被験者のMRIスキャンを自動的かつ正確に位置合わせすることができるものとします。 |
| 空間マッピング:visits間の共同登録 | 画像分析ワークステーション | この取り組みが実施された場合、複数のPET visitsを互いに自動的かつ正確に空間的に合わせることができるものとします。 |
| 空間マッピング:テンプレートへのワープ | 画像分析ワークステーション | この取り組みが実施された場合、被験者のスキャンとテンプレートを自動的かつ正確に空間的にマップすることができるものとします。 |
| 対象および参照領域の定義 | 画像分析ワークステーション | 被験者のスキャンに適用される対象領域と参照領域の境界を規定するため、または(被験者MRIの分裂から作成された、あるいは画像テンプレートおよびアトラスに基づいて規定済みの)他のソフトウェアを使用して作成された規定済みの関心領域境界(あるいはマスク)をインポートする方法を与えます。 |
| SUVR画像作成 | 画像分析ワークステーション | このオプションが実装されている場合、各ボクセルを選択された参照領域内の平均値で除算することでSUVR画像を作成できます。 |
| 領域配置 | 画像分析ワークステーション | あらかじめ指定された関心領域を解剖学的に正確な方法でPETスキャン上に適用(測定のために配置)できます。 |
| 領域配置の品質管理 | 画像分析ワークステーション | (最終領域配置検査および/または、各画像操作段階で実施される検査および/または、自動画質測定によって)測定領域がPETスキャン上に正確に配置された品質保証の方法を与えます。 |
| 関心領域の測定 | 画像分析ワークステーション | (SUVR画像に基づかない場合)、各関心領域内の平均値を計算し、SUVR計算および/または報告のために保存することができるものとします。 |
| SUVR計算 | 画像分析ワークステーション | (SUVR画像に基づかない場合)、対象領域の平均値を参照領域の平均値で割ることで、SUVR値を計算することができます。 |
| SUVRアウトプット | 画像分析ワークステーション | 研究プロトコールで必要な精度に合わせた表示、及び研究報告書への転送のためにSUVR値を記憶し、出力することができるものとします。 |
4.5.パフォーマンス評価:ソフトウェアバージョンのトラッキング
理想的には、PETスキャナーは全ソフトウェアバージョンの日付コンソールにリストすることができるはずです(定量的精度に影響を与えるソフトウェアの変更は、通常ハードウェアの変更を含みます)。さらにスキャナーソフトウェアのバージョンは試験中にスキャナーソフトウェアのアップデートや変更とともに、時間の経過に従って識別、追跡される必要があります。最低限、ソフトウェアバージョンはファントムイメージ実行データとともに資格取得中に手動で記録され、試験期間中のソフトウェアアップグレード毎に記録を更新する必要があります。これは、現時点で定量化への影響のフラグを立てることを、また将来的には全ソフトウェアバージョン番号をDICOMヘッダーに記録することを含みます。
| パラメーター | エンティティ/アクター | 仕様 |
| ソフトウェアバージョントラッキング | 取得装置 | 取得および再構成に使用されたソフトウェアバージョンを適切なDICOMフィールドに記録します。 |
| ソフトウェアバージョンのバックテスト互換性 | ワークステーション | 以前の(プラットフォーム特有の)ものだけでなく、アップロードされたバージョンの分析ソフトウェアも使用し、画像データの分析をもたらすメカニズムを提供します。 |
参考文献
試験・再試験論文と方法論
- Clinical Validation of 18F-AZD4694, an Amyloid-b–Specific PET Radioligand, Zsolt Csele´nyi, Maria Eriksdotter Jo¨nhagen, Anton Forsberg, Christer Halldin, Per Julin, Magnus Schou, Peter Johnstro¨m, Katarina Varna¨s, Samuel Svensson, and Lars Farde, J Nucl Med 2012; 53:415–424, DOI:10.2967/jnumed.111.094029.
- Performance Characteristics of Amyloid PET with Florbetapir F 18 in Patients with Alzheimer’s Disease and Cognitively Normal Subjects, Abhinay D. Joshi, Michael J. Pontecorvo, Chrisopher M. Clark, Alan P. Carpenter, Danna L. Jennings, Carl H. Sadowsky, Lee P. Adler, Karel D. Kovnat, John P. Seibyl, Anupa Arora, Krishnendu Saha, Jason D. Burns, Mark J. Lowrey, MarkA.Mintun, Daniel M. Skovronsky, and the Florbetapir F 18 Study Investigators, J Nucl Med 2012; 53:378–384, DOI: 10.2967/jnumed.111.090340.
- 18F-Flutemetamol Amyloid Imaging in Alzheimer Disease and Mild Cognitive Impairment A Phase 2 Trial, Rik Vandenberghe, MD, PhD, Koen Van Laere, MD, PhD, Adrian Ivanoiu, MD, PhD, Eric Salmon, MD, PhD, Christine Bastin, PhD, Eric Triau, MD, Steen Hasselbalch, MD, DMSc, Ian Law, MD, PhD, Allan Andersen, MD, Alex Korner, MD, PhD, Lennart Minthon, MD, Gae¨ tan Garraux, MD, PhD, Natalie Nelissen, PhD, Guy Bormans, PhD, Chris Buckley, MD, Rikard Owenius, Lennart Thurfje, Gill Farrar, PhD, and David J. Brooks, MD, DSc, FRCP, ANN NEUROL 2010;68:319–329, DOI: 10.1002/ana.22068. Eur J Nucl Med Mol Imaging (2009) 36:1629–1638, DOI 10.1007/s00259-009-1129-6.
- Test-retest variability of quantitative [11C] PIB studies in Alzheimer’s disease. Nelleke Tolboom, Maqsood Yaqub, Ronald Boellaard, Gert Luurtsema, Albert D. Windhorst, Philip Scheltens, Adriaan A. Lammertsma, Bart N. M. van Berckel.
- Longitudinal Assessment of Aß and Cognition in Aging and Alzheimer Disease, Victor L. Villemagne, Kerryn E. Pike, Gaël Chételat, Kathryn A. Ellis, Rachel S. Mulligan, Pierrick Bourgeat, Uwe Ackermann, Gareth Jones, Cassandra Szoeke, Olivier Salvado, Ralph Martins, Graeme O’Keefe, Chester A. Mathis, William E. Klunk, David Ames, Colin L. Masters, and Christopher C. Rowe. Ann Neurol. 2011 January ; 69(1): 181–192. doi:10.1002/ana.22248.
- Amyloid Imaging with 18F-Florbetaben in Alzheimer Disease and Other Dementias, Victor L. Villemagne, Kevin Ong, Rachel S. Mulligan, Gerhard Holl, Svetlana Pejoska, Gareth Jones, Graeme O’Keefe, Uwe Ackerman, Henri Tochon-Danguy, J. Gordon Chan, Cornelia B. Reininger, Lueder Fels, Barbara Putz, Beate Rohde, Colin L. Masters, and Christopher C. Rowe. J Nucl Med 2011; 52:1210–1217, DOI: 10.2967/jnumed.111.089730
- Test-retest variability of high and low SA [18F] BAY 94-9172 in Alzheimer's disease and normal ageing. C. C. Rowe, S. Pejoska, R. Mulligan, G. Chan, L. Fels, H. Kusi,2 C. Reininger,2 B. Rohde,2 B. Putz, V. L. Villemagne. Poster presented at the Society of Nuclear Medicine Meeting, Salt Lake City, UT, 2009.
Centiloid 論文
- THE CENTILOID SCALE: STANDARDIZATION OF AMYLOID IMAGING MEASURES, Christopher Rowe,William Klunk, Robert Koeppe, William Jagust, Michael Pontecorvo, Michael Devous, Marybeth Howlett, Daniel Skovronsky, Keith Johnson, Julie Price, Chet Mathis, Mark Mintun, Alzheimer's & Dementia: The Journal of the Alzheimer's Association Volume 9, Issue 4, Supplement , Page P8, July 2013, doi:10.1016/j.jalz.2013.04.026.
非画像DX 試験
- Plasma phospholipids identify antecedent memory impairment in older adults, Mark Mapstone, Amrita K Cheema, Massimo S Fiandaca, Xiaogang Zhong, Timothy R Mhyre, Linda H MacArthur, William J Hall, Susan G Fisher, Derick R Peterson, James M Haley, Michael D Nazar, Steven A Rich, Dan J Berlau, Carrie B Peltz, Ming T Tan, Claudia H Kawas & Howard J Federoff, Nature Medicine advance online publication, March 2014, doi:10.1038/nm.3466. 1352
アルツハイマー病発症に関する医学関連リスト
- Medicines in Development Alzheimer’s Disease presented by America’s Biopharmaceutical Research Companies (PhRMA), 2013 Report,http://www.phrma.org/sites/default/files/Alzheimer's%202013.pdf.
ADNI 参考文献 (http://www.adni-info.org/scientists/ADNIStudyProcedures.aspx)
- ADNI II Procedures Manual http://www.adniinfo.org/Scientists/Pdfs/adniproceduresmanual12.pdf
- ADNI Protocol - http://www.adni-info.org/Scientists/Pdfs/ADNI2_Protocol_FINAL_20100917.pdf 3. Review Articles - The Alzheimer’s Disease Neuroimaging Initiative: Progress report and future plans Michael W. Weiner, Paul S. Aisen, Clifford R. Jack, Jr., William J. Jagust, John Q. Trojanowski, Leslie Shaw, Andrew J. Saykin, John C. Morris, Nigel Cairns,Laurel A. Beckett, Arthur Toga, Robert Green, Sarah Walter, Holly Soares, Peter Snyder,Eric Siemers, William Potter, Patricia E. Cole, Mark Schmidt; and the Alzheimer’s Disease Neuroimaging Initiative Alzheimer’s & Dementia 6 (2010) 202–211 1363
アミロイドPET: 臨床
- Appropriate use criteria for amyloid PET: A report of the Amyloid Imaging Task Force, the Society of Nuclear Medicine and Molecular Imaging, and the Alzheimer’s Association. Keith A. Johnson, Satoshi Minoshima, Nicolaas I. Bohnen, Kevin J. Donohoe, Norman L. Foster, Peter Herscovitch, Jason H. Karlawish, Christopher C. Rowe, Maria C. Carrillo, Dean M. Hartley, Saima Hedrick, Virginia Pappas, William H. Thies
- Update on Appropriate Use Criteria for Amyloid PET Imaging: Dementia Experts, Mild Cognitive Impairment, and Education. Keith A. Johnson, Satoshi Minoshima, Nicolaas I. Bohnen, Kevin J. Donohoe, Norman L. Foster, Peter Herscovitch, Jason H. Karlawish, Christopher C. Rowe, Saima Hedrick, Virginia Pappas, Maria C. Carrillo, and Dean M. Hartley, J Nucl Med 2013; 54:1011–1013, DOI: 10.2967/jnumed.113.127068.
- Pending journal permission: Schmidt ME et al, Manuscript regarding Approaches to Reduce Variability in Amyloid Imaging – this manuscript will contain a list of references, all of which could be applicable
- Book chapter: Schmidt ME, Matthews D, Andrews R, Mosconi L. Positron Emission Tomography in Alzheimer Disease: Diagnosis and Use ad Biomarker Endpoints. Chapter 5, p. 131-194. Translational Neuroimaging – Tools for CNS Drug Discovery, Development, and Treatment, McArthur RA editor, 2013, Academic Press. This, too, contains a comprehensive list of references.
- Analysis method paper: Lundqvist R, Lilja J, Thomas BA, Lötjönen J, Villemagne VL, Rowe CC, Thurfjell L. Implementation and validation of an adaptive template registration method for 18F-flutemetamol imaging data. J Nucl Med. 2013 Aug;54(8):1472-8. There are several additional papers that pertain to PiB also, by the Klunk/Price group at Pittsburgh.
- Scanner quality control: Makris NE, Huisman MC, Kinahan PE, Lammertsma AA, Boellaard R. Evaluation of strategies towards harmonization of FDG PET/CT studies in multicentre trials: comparison of scanner validation phantoms and data analysis procedures. Eur J Nucl Med Mol Imaging. 2013 Oct;40(10):1507-15.
アミロイドPET:定量的ダイナミックイメージングと方法論
- Hiroshi Ito, Hitoshi Shimada, Hitoshi Shinotoh, Harumasa Takano, Takeshi Sasaki, Tsuyoshi Nogami, Masayuki Suzuki, Tomohisa Nagashima, Keisuke Takahata, Chie Seki, Fumitoshi Kodaka, Yoko Eguchi, Hironobu Fujiwara, Yasuyuki Kimura, Shigeki Hirano, Yoko Ikoma, Makoto Higuchi, Kazunori Kawamura, Toshimitsu Fukumura, Éva Lindström Böö, Lars Farde and Tetsuya Suhara. Quantitative Analysis of Amyloid Deposition in Alzheimer Disease Using PET and the Radiotracer 11C-AZD2184, Published online: April 14, 2014.J Nucl Med., Doi: 10.2967/jnumed.113.133793
- Longitudinal Amyloid Imaging Using 11C-PiB: Methodologic Considerations. Bart N.M. van Berckel, Rik Ossenkoppele, Nelleke Tolboom, Maqsood Yaqub, Jessica C. Foster-Dingley, Albert D. Windhorst, Philip Scheltens, Adriaan A. Lammertsma, and Ronald Boellaard. J Nucl Med 2013; 54:1570–1576, DOI: 10.2967/jnumed.112.113654.
- Amyloid-B Imaging with Pittsburgh Compound B and Florbetapir: Comparing Radiotracers and Quantification Methods Susan M. Landau1–3, Christopher Breault3, Abhinay D. Joshi3, Michael Pontecorvo3, Chester A. Mathis4, William J. Jagust1,2,5, and Mark A. Mintun3, for the Alzheimer’s Disease Neuroimaging Initiative
- PET Quantification of 18F-Florbetaben Binding to b-Amyloid Deposits in Human Brains. Georg A. Becker, Masanori Ichise, Henryk Barthel, Julia Luthardt, Marianne Patt, Anita Seese, Marcus Schultze-Mosgau, Beate Rohde, Hermann-Josef Gertz, Cornelia Reininger, and Osama Sabri. J Nucl Med 2013; 54:723–731, DOI: 10.2967/jnumed.112.107185.
- Automated Quantification of 18F-Flutemetamol PET Activity for Categorizing Scans as Negative or Positive for Brain Amyloid: Concordance with Visual Image Reads. Lennart Thurfjell, Johan Lilja, Roger Lundqvist, Chris Buckley, Adrian Smith, Rik Vandenberghe and Paul Sherwin. J Nucl Med 2014; 55:1623-1628.
- Accuracy of CT-based attenuation correction in PET/CT bone imaging. M. Abella, A. M. Alessio, D. A. Mankoff, L. R. Macdonald, J. J. Vaquero, M. Desco, and P. E. Kinahan. Phys. Med. Biol May 2012; 57:9,. 2477–2490.
Package Inserts
- Amyvid [package insert]. 2012. Available at: http://pi.lilly.com/us/amyvid-uspi.pdf. AccessedJune11, 2013. 1415
- Vizamyl [package insert]. 2013. Available at: http://www3.gehealthcare.com/en/Products/Categories/~/media/Downloads/us/Product/Product-Categories/Nuclear-Imaging-Agents_Non-Gatekeeper/Vizamyl/GEHealthcare-Vizamyl-Prescribing-Information.pdf. Accessed May 5, 2014.
- Neuraceq [package insert]. 2014. Available at: http://www.accessdata.fda.gov/drugsatfda_docs/label/2014/204677s000lbl.pdf. Accessed May 5, 2014.
付録A:謝辞と帰属
北米放射生物学会(RSNA)Quantitative Imaging Biomarker Alliance(QIBA)核医学調整委員会によって、この文書は提供されています。
核医学調整委員会の小委員会であるアミロイドPETバイオマーカー委員会は、画像機器製造業者、画像分析ソフトウェア開発者、画像解析施設および研究所、生物医薬品企業、学術機関、政府研究機関を代表する医師、科学者、 組織、専門家団体、規制当局などから構成されています。
QIBAアミロイド-PETバイオマーカー委員会およびその研究のより詳細な説明は、以下のwebリンクから見ることができます。http://qibawiki.rsna.org/index.php/PET_Amyloid_Biomarker_Ctte
アミロイドPETバイオマーカー委員会構成員(アルファベット順)
| QIBANM PET Amyloid Biomarker Committee Profile Co-Authors: | |
| Ronald Boellaard, PhD | University of Groningёn (the Netherlands) |
| Paul E. Kinahan, PhD | University of Washington |
| Gregory Klein, PhD | F. Hoffmann - La Roche Ltd. |
| Adriaan A. Lammertsma, PhD | VU University Medical Center |
| Dawn C. Matthews, MS, MBA | ADM Diagnostics, LLC |
| Satoshi Minoshima, MD, PhD | University of Utah |
| Nancy Obuchowski, PhD | Cleveland Clinic Foundation |
| Eric S. Perlman, MD | Perlman Advisory Group, LLC |
| Anne M. Smith, PhD | Siemens Medical Solutions USA, Inc. |
| Jean-Luc Vanderheyden, PhD | JLVMI Consulting LLC |
| QIBA NM PET Amyloid Biomarker Committee Profile Contributors: | |
| Keith Allberg | RadQual, LLC |
| Matjaz Baraga, MD | University Medical Centre Ljubljana |
| Parviz Behfarin, MD | Plainview Hospital |
| Orest B. Boyko, MD, PhD | University of Southern California |
| Andrew J. Buckler, MS | Elucid Bioimaging Inc. |
| Christopher Buckley, PhD | GE Healthcare |
| Santiago (Santi) Bullich, PhD | Piramal Imaging (Germany) |
| Hyo-Min Cho, PhD | Korea Research Institute of Standards and Science |
| Patricia E. Cole, PhD, MD | Takeda Pharmaceuticals |
| José Luis Criales Cortés, MD | Universidad Anáhuac |
| Susan M. De Santi, PhD | Piramal |
| Michael D. Devous, Sr, PhD | Avid Radiopharmaceuticals |
| Volker Dicken, PhD | Fraunhofer MEVIS (Germany) |
| Alexander Drzezga, MD | University Hospital Cologne |
| Edward A. Eikman, MD | Moffitt Cancer Center |
| Rachid Fahmi, MSc, PhD | Siemens Medical Solutions USA, Inc. |
| Andrea Ferrero, PhD | Mayo Clinic |
| P. Thomas Fletcher, PhD | University of Utah, Scientific Computing & Imaging Institute |
| Norman L. Foster, MD | University of Utah |
| Anthony Fotenos, MD, PhD (MSTP) | Division of Medical Imaging Products at CDER/FDA |
| Amy Fowler, MD, PhD | University of Wisconsin, School of Medicine & Public Health |
| Kirk Frey, MD, PhD | University of Michigan |
| Jerry Froelich MD | University of Minnesota |
| Constantine Gatsonis, PhD | Brown University |
| Alexander Guimaraes, MD, PhD | Oregon Health & Science University |
| Anurag Gupta, PhD | PAREXEL International |
| Albert Guvenis, PhD | Institute for Biomedical Engineering, Bogazici University |
| Jun Hatazawa, MD | Osaka University, Dept. of Nuclear Medicine and Tracer Kinetics |
| John M. Hoffman, MD | University of Utah |
| Makoto Hosono, MD, PhD | Kinki University |
| Masanobu Ibaraki, PhD | Akita Prefectural Hospital Organization, |
| Hidehiro Iida, DSc, PhD | National Cerebral & Cardiovascular Center (Osaka, Japan) |
| Edward F. Jackson, PhD | University of Wisconsin, School of Medicine & Public Health |
| Abhinay D. Joshi, MS | Avid Radiopharmaceuticals / Eli Lilly |
| Tomohiro Kaneta, MD, PhD | Yokohama City University Graduate School of Medicine |
| Vasileios K. Katsaros, MD, PhD | University of Athens (Greece) |
| Tatsuaki Kobayashi, MS | Visionary Imaging Services, Inc. |
| Robert Koeppe, PhD | University of Michigan |
| Eun-jung Kong, MD | Yeungnam University Medical Center (Korea) |
| Arden J. Kwan, MBBS | The Permanente Medical Group (TPMG) |
| Ben Kwan, MD | Western University, Ontario |
| Martin A. Lodge, PhD | Johns Hopkins University School of Medicine |
| Lawrence (Larry) R. MacDonald, PhD | University of Washington |
| Nobutoku Motomura, PhD | Toshiba |
| P. David Mozley, MD | Endocyte, Inc. |
| Mahoto Mugita, BS | Micron, Inc. |
| Aaron S. Nelson, MD | MIMvista Corp. |
| Dennis Nelson, PhD | MIMvista Corp. |
| Yoshihiro Nishiyama, MD | Kagawa University, Faculty of Medicine Dept. of Radiology |
| Amy Perkins, PhD | Philips |
| Cornelia B. Reininger, MD, PhD | Navidea Biopharmaceuticals |
| Haris Sair, MD | Johns Hopkins University |
| R. Chandrasiri Samaratunga, PhD | University of Cincinnati |
| Sandra Sanabria, PhD | Genentech |
| Ramkumar Saptharishi, PhD | Philips |
| Annette Schmid, PhD | Takeda Pharmaceuticals |
| Mark E. Schmidt, MD | Janssen Research and Development (Belgium) |
| Sara Sheikhbahaei, PhD | Johns Hopkins University School of Medicine |
| Satinder P. Singh, MD | University of Alabama at Birmingham |
| Charles Smith, MSCS | Numa Inc. |
| Lilja B. Solnes, MD | University of Maryland |
| Rohit Sood, MD, PhD | PAREXEL International |
| Rathan Subramaniam, MD, PhD, MPH | UT Southwestern Medical Center |
| Daniel C. Sullivan, MD | Duke University |
| Na Sun, PhD | Yokohama City University Graduate School of Medicine |
| John J. Sunderland, PhD | University of Iowa |
| Mitsuaki Tatsumi, MD | Osaka University |
| Huseyin G. Toré | University of Minnesota |
| Benjamin M.W. Tsui, PhD | Johns Hopkins University School of Medicine |
| Lauren Uzdienski, BFA | Technical Writer |
| Ronald Van Heertum, MD | BioClinica, Inc. |
| Richard L. Wahl, MD, FACR | Mallinckrodt Institute of Radiology, Washington University |
| Angela Y. Wang, PhD | The University of Utah |
| Wolfgang Weber, MD | Memorial Sloan-Kettering Cancer Center |
| Shuji Yamamoto, PhD | National Cancer Center (Japan) |
| Brian E. Zimmerman, PhD | National Institute of Standards and Technology (NIST) |
アミロイドPETバイオマーカー委員会と核医学調整委員会は、北米放射線学会のスタッフが提供していただく援助と技術支援に深く感謝しています。
付録B:クレームの背景情報
入手可能な文献を用いながら11C-ピッツバーグ化合物-B(11C-PIB)および18フッ素標識放射性トレーサーによるアミロイドPETイメージングの再現性を決定するための基礎研究として、メタ分析が行われました。このメタ分析には合計7つの研究が含まれていました。4つの研究で、18種類のフッ素標識アミロイドトレーサー(Florbetapir、AZD4694、Flutemetamol、Florbetaben)の試験・再試験の変動性が評価されました。試験・再試験アミロイドPET試験は、1〜4週間間隔で行われました。 AD患者(n = 26)の平均皮質SUVRのためにプールされた%RCは、10.36%(95%信頼区=4.76-14.92)でした。HC(n = 22)における平均皮質SUVRのためにプールされた平均%RCは、10.41(95%信頼区間= 3.33-20.3)でした。3件の研究で、11C-PIBアミロイドイメージングの試験・再試験の変動性が評価されました。試験・再試験アミロイドPET試験は、同じ日に実施され、また60日以内の間隔で実施されていました。平均皮質SUVRのプールされた平均%RCは15.4%(95%信頼区間= 8.49-20.05)でした。HC(n = 16)における平均皮質SUVRのプールされた平均%RCは9.38%(95%信頼区間= 7.55-10.92)でした。
付録C:規約と定義
プロファイル要件を表すために使用される規約
このプロファイルを遵守するための要件は、以下の例に示す表/ボックスに表示されています。
網掛けのボックス部分は今後の要件であり、現時点でプロファイル遵守に必要とされてはいません。
説明例:
パラメーター エンティティ/アクター 標準テキスト:クリアボックスは現在の要件です。
網掛けのボックス:将来の要件を想定しています。
| ファントムテスト:軸位方向均一性の測定 | 画像部位 | ACRを使用することで、均一な円筒ファントムまたは同等物が、1.0の大きな中心ROI(0.9~1.1の許容範囲)に対してSUVを取得します。 |
| AC、つまり均一な円筒ファントムまたはそれと同等物を使用することで、1.0の大きな中心ROI(許容範囲0.95〜1.05)に対してSUVを取得します。 |
表内の項目は規範的です(つまりQIBAプロファイルに準拠する必要があります)。
実施を容易にするため、標準テキストの意図は規範的かつ詳細なものになっています。
一般的に、どのように達成するかではなく、最終的な状態や出力を特定することを意図しています。表外にある他の全テキストは、参考情報のみとみなされます。
定義
| 3D | 3次元 |
| 11C | 炭素-11、炭素の同位体 |
| 18F | フッ素-18、フッ素の同位体 |
| AB | アミロイド-Β |
| AC | 減衰補正。減衰は、体内の放射性トレーサーによって放出された光子が、介在する組織によって吸収されるときに生じる効果です。その結果、身体の深部構造は、誤って低い(または負の)トレーサー取り込みを有するものとして再構築されます。現代のPET / CTスキャナーは、統合されたX線CT装置を用いて減衰を推定します。減衰補正された画像は、一般的には放射性トレーサー分布を忠実に表現していますが、補正プロセス自体が重大なアーチファクトの影響を受けやすいとされます。 |
| Accreditation | 広範な臨床使用(継続中のQA / QCが必要)のため、独立した機関または団体による承認。例:ACR、IAC、TJC。 |
| AD | アルツハイマー病 |
| ALARA | 合理的に達成可能な限り低く |
| BBB | 血液脳関門 |
| BPND | 潜在的な結合力。BPNDは、置換不能なコンパートメント中のリガンド遊離画分について補正された、受容体のトレーサー親和性に対する利用可能な受容体の密度の比です。 |
| CLIA | Clinical Laboratory Improvement Amendments:臨床検査の品質基準を確立するための認定制度。 |
| Co-57 | コバルト-57、コバルトの同位元素 |
| Conformance | この文書に記載されている要件リストを満たしていること。 このQIBAプロファイルの測定要求を満たすために必要とされています。 |
| CRF | 症例報告書(CRF)は、臨床試験の研究に特に使用される用紙または電子アンケートのことです。CRFは、臨床試験のスポンサー(または指定されたCROなど)が各参加サイトからデータを収集するために使用されます。 臨床試験に参加する各患者のすべてのデータは、有害事象を含めCRFに保持され、かつ/または文書化されます。 |
| CRO | Contract Research Organization 契約研究機関。 臨床試験中に生じたデータの集中的かつ標準化された収集、分析、および/またはレビューを実行するように指定された商業または非営利団体。画像の中核研究所で実施できるその他の活動には、臨床試験で必要とされる特定画像の画像センターとしてのトレーニングと資格認定、画像取得マニュアルの開発、独立した画像審査チャーターの開発、研究所から受け取った画像の集中収集とアーカイブ、送られてくる画像に対する事前指定の品質管理チェック/テスト、提出された画像が調査プロトコールで指定された画像化の時点と一致し、規定された分析/評価のプロトコールを遵守するよう要求された品質と一貫している事を確認するための品質保証過程と手順の開発および実施が含まれている。 |
| Cs-137 | セシウム-137、セシウムの同位体 |
| CSF | 脳脊髄液 |
| CT | X線コンピューター断層撮影(CT)は、組織密度に密接に関連している相対X線吸収の断層画像を生成するために、X線を利用する医療画像技術です。 |
| CTDI | コンピューター断層撮影線量指数 |
| DICOM | 医療におけるデジタルイメージングとコミュニケーション(DICOM)は、医用画像と関連情報のための一連の標準規格です。これは、臨床使用に必要なデータと品質を保持する方法で、交換可能な医療画像フォーマットと定義されます。 |
| DLP | Dose length product |
| Dose | 放射線量または「総放射能」の専門用語として言及することができます。例えば、10mCiの18F-FDGは、しばしば10mCi用量と呼ばれます。 |
| DRO | Digital Reference Object |
| DVR | 分布容積率 |
| FDG | フルオロデオキシグルコース |
| FWHM | Full width at half maximum 最大値の1/2時の全幅 |
| HIPAA | 医療保険の携帯性と説明責任に関する法律 |
| IAC | 国際機関認定委員会(IAC)は、血管検査、心エコー検査、核/ PET、MRI、CT /歯科、頸動脈ステント留置および静脈センターの認定プログラムを提供しています。 |
| IAEA | 国際原子力機関 |
| IOD | Information Object Definition |
| kBq | キロベクレル |
| kVp | ピークキロ電圧 |
| LBM | 除脂肪体重は、全体重から体脂肪重量を引くことによって計算されます。LBMは、適切なレベルの薬物を処方し、代謝障害を評価するための総体重より優れた指標として記載されています。 |
| mAs | ミリアンペア-秒 |
| MBq | メガベクレル。1秒あたり1.0×10 ^ 6の崩壊と定義される放射能のSI由来単位。 |
| MCI | 中等度認知機能障害 |
| mCi | ミリキューリー。1mCi = 3.7×10 ^ 7崩壊/秒と定義される非SI単位の放射能。 臨床FDG-PET試験では、(通常)5〜15mCiの18F-FDGを注射します。 |
| mpi | 注入後の分 |
| MRI | 磁場共鳴画像 |
| NA | 北米 |
| NTP | ネットワークタイムプロトコール |
| PACS | 画像アーカイブと通信システム |
| PiB | ピッツバーグ化合物B、チオフラビンTの放射性類似体。 |
| PET | 陽電子放射断層撮影法(PET)は、放射性トレーサー(典型的にはFDG)の生体内分布画像を生成する断層撮影技術です。 |
| PET/CT | 陽電子放射断層撮影/コンピューター断層撮影(PET / CT)は、陽電子放射断層撮影(PET)スキャナーとX線コンピューター断層撮影(CT)スキャナーの両方を1つのガントリシステムに組み込んだ医療用画像システムであり、 ほぼ同時に撮影することができます。 |
| PSF | Point Spread Function |
| PVEc | パーシャルボリュームエフェクト補正 |
| QA | 品質保証。タスク・パフォーマンスの積極的な定義。サービスまたは製品の品質が、特に納品または生産のプロセスのすべての段階において注意が払われる事で、望ましいレベルに維持される事。 |
| QC | 品質管理。QAプログラムの目標要件を確実に満たすために実施された具体的なテスト。典型的には、仕様に対する出力サンプルをテストすることによって行われます。 |
| QIBA | 定量的イメージングバイオマーカー同盟。Quantitative Imaging Biomarkers Alliance(QIBA)は、定量的イメージングの進歩と臨床試験・実臨床におけるバイオマーカーの使用時において、研究者、医療従事者、業界関係者を結集させるべく、2007年にRSNAによって組織されました。 |
| Qualification | 臨床研究(ACRIN-CQIE、SNM-CTNその他)または特定の臨床試験(継続的なQA / QCが必要)の一般的な参加のために独立した機関または団体によって承認されました。これには、CRO、ACRIN、SNM-CTN、CALGBおよびその他の中核研究機関が含まれます。 |
| ROI | 関心領域。何らかの方法で指定された画像内の領域で、通常、2D領域または3Dボリュームのいずれかになりうるユーザー制御のグラフィック要素を使用します。これらの要素には、楕円、楕円、長方形、長方形のボリューム、円、円柱、多角形、自由形状の形状が含まれますが、これらに限定されません。ROIは、画像上で動作するセグメンテーションアルゴリズムによっても定義できます。セグメンテーションアルゴリズムには、固定値スレッショルド、固定パーセンテージスレッショルド、グラディエントエッジ検出、ベイジアンメソッドなどがありますが、これらに限定されません。ROIの定義により、ROI内の画像部分についてメトリックが計算されます。これらのメトリックには、平均値、最大値、標準偏差、ボリュームまたは面積が含まれますが、これらに限定されません。ROIという用語は、単一の画像スライスまたは3Dボリューム上の2D領域を参照できます。場合によっては、ROIという用語は2D領域を指すために使用され、用語のボリューム(VOI)は3Dボリュームを指すために使用されます。このプロファイルでは、必要に応じて2D領域と3Dボリュームの両方を参照するためにROIという用語が使用されています。 |
| SUV | 標準化された取り込み値。身体内の相対的放射性トレーサー摂取量の尺度。典型的には、時点tに対して定義されます。 |
| SUVmax | ROI内の最大SUV。 |
| SUVmean | ROI内の平均SUV。 |
| SUVpeak | 固定サイズのROI内の平均SUV(通常は直径1cmの球)。球の位置は、平均SUVが最大になるように調節されます。 |
| Tc-99m | Technetium-99m、テクネチウムの同位体 |
| TOF | Time of Flight(TOF)は、放射性トレーサーの生体内分布をより正確に位置特定するために、差分消滅フォトン移動時間を利用するPET画像技術です。 |
| USP | 米国薬局方条約は、米国における医薬品、食品成分、栄養補助食品および成分に関する書面および物理(参照用)基準を定めています。 |
| VOI | 関心ボリューム領域 |
組織団体
| AAPM | The American Association of Physicists in Medicineは、医学物理学、放射線腫瘍学、イメージング物理学の話題に関心のある会員社会です。AAPMは、8156人の医学物理学士で組織される科学的、教育的、専門的な集団です。 |
| ABNM | American Board of Nuclear Medicine |
| ABR | The American Board of Radiology |
| ABSNM | Nuclear Medicine Physics by the American Board of Science in Nuclear Medicine |
| ACR | 放射線医、放射線腫瘍医、医学物理士、介入放射線医、核医学医、関連する医療専門家など36,000人のメンバーが参加しています。 |
| ACRIN | American College of Radiology Imaging Network(ACRIN)はAmerican College of Radiologyと国立がん研究所協同組合のプログラムです。臨床試験における、がん関連の研究に焦点を当てています。 |
| ANSI | American National Standards Institute |
| CQIE | CQIEプログラムは、国立がん研究所(NCI)を代表してSAIC-Frederickにより2009年12月に発行された提案の勧誘に応えて、ACRINによって開発されました。CQIEプログラムの第一の目的は、NCIがんセンタープログラム内に、分子および/または機能的に高度なイメージングエンドポイントが存在する臨床試験を行うことができる「治験準備」サイトのリソースを確立することです。 |
| CRO | Contract Research Organization 契約研究機関。 臨床試験中に生じたデータの集中的かつ標準化された収集、分析、および/またはレビューを実行するように指定された商業または非営利団体。画像の中核研究所で実施できるその他の活動には、臨床試験で必要とされる特定画像の画像センターとしてのトレーニングと資格認定、画像取得マニュアルの開発、独立した画像審査チャーターの開発、研究所から受け取った画像の集中収集とアーカイブ、送られてくる画像に対する事前指定の品質管理チェック/テスト、提出された画像が調査プロトコールで指定された画像化の時点と一致し、規定された分析/評価のプロトコールを遵守するよう要求された品質と一貫している事を確認するための品質保証過程と手順の開発および実施が含まれています。 |
| CTN | 臨床試験ネットワーク(CTN)は、臨床試験において分子イメージングバイオマーカーの効果的な使用を促進するために、2008年にSNMMIによって形成されました。 |
| EANM | 欧州核医学協会(EANM)は、欧州核医学の傘下組織です。 |
| EARL | EANM Research Ltd(EARL)は、多施設での核医学と研究を促進するため、2006年にEANMによって設立されました。 |
| ECOG-ACRIN | 国立癌研究所協同組合は、2012年の東協同腫瘍学グループ(ECOG)と米国放射線学会画像ネットワーク(ACRIN)の合併により形成されました。 |
| EMA | 欧州医薬品庁は、医薬品の評価を行う欧州連合(EU)の機関です。米国食品医薬品局(FDA)とほぼ同義ですが、FDAスタイルの中央集権はありません。 |
| EU | 欧州連合 |
| FDA | 米国食品医薬品局(FDA)は、食品安全、たばこ製品、栄養補助食品、処方薬および市販医薬品、ワクチン、バイオ医薬品、輸血、医療機器、電磁放射線を放出する装置、および獣医製品などの規制と監督を通じて、米国の公衆衛生を保護、促進する責任を負います。 |
| HIPAA | 医療保険の携帯性と説明責任に関する法律 |
| IAC | 国際機関認定委員会(IAC)は、血管検査、心エコー検査、核/ PET、MRI、CT /歯科、頸動脈ステント留置および静脈センターの認定プログラムを提供しています。 |
| IAEA | 国際原子力機関 |
| MITA | Medical Imaging&Technology Allianceは、医用イメージングおよび放射線治療機器の標準を開発・推進する部門NEMAです。これらの基準は、イメージングおよびがん治療製品の設計、製造、試験、および通信の一般的に受け入れられている方法を確立する自主的ガイドラインです。 |
| NEMA | National Electrical Manufacturers Associationは、電気機器メーカーが技術標準を策定するためのフォーラムです。 |
| NIST | 国立標準技術研究所は、米国商務省の非規制機関である測定標準研究所です。 |
| QIBA | 定量的イメージングバイオマーカー同盟。 Quantitative Imaging Biomarkers Alliance(QIBA)は、定量的イメージングの進歩と臨床試験・実臨床におけるバイオマーカーの使用時において、研究者、医療従事者、業界関係者を結集させるべく、2007年にRSNAによって組織されました。 |
| RSNA | 北米放射線学会(RSNA)。放射線専門医、放射線腫瘍医、医学物理士、同盟関係の科学者など47,000人以上の構成員を擁する専門的な医療画像学会。RSNAは世界最大の毎年の医療会議を開催しています。 |
| SNMMI | SNMMI(以前は核医学会(SNM)と呼ばれていました)。核医学および分子イメージングの科学、技術、および実用化を促進する非営利組織です。SNMMIは、世界中18,000人の核および分子イメージング専門家を代表しています。メンバーには、医師、技師、物理士、薬剤師、科学者、研究室の専門家などが含まれます。 |
| TJC | 合同委員会(TJC)は、米国の医療機関とプログラムを認証し、認定します。 |
| UPICT | 臨床試験画像のための統一プロトコール(UPICT)。機関、協同組合、治験協議会の臨床試験をサポートする注釈付きプロトコールのライブラリを提供しようとするRSNA-QIBA主導のプロトコールです。 UPICTプロトコールは、画像データ品質を確保するため、最低限の基準を満たすコンセンサス規格に基づいています。 |
付録 D: モデル固有の指導とパラメーター
以下の表に特定の製品モデル/バージョンが存在することで、これらの製品がQIBAプロファイルに完全に準拠していることを意味するものではありません。 プロファイルとの適合は、様々な要件を満たすことを意味し、これらパラメーターによる操作が単に1つであることです。製品(およびその製品の特定モデル/バージョン)が適合しているかどうかを判断するには、その製品のQIBA適合文書を参照してください。
D.1.画像取得のパラメーター
以下の技術表は、セクション3.6.4(「ファントムイメージング」)の要件を満たすデータ生成が期待される特定モデル/バージョンの取得パラメーター値をリスト化しています。
これらの技術表は、このイメージングプロトコール文書の提出者、臨床試験組織者、装置のベンダー、および/または他の何らかの情報源によって準備されている可能性があります。(結果的に、与えられたモデル/バージョンは複数の表に現れることがあります)。情報源は各表の一番上に表示されます。
ここに記載されているモデルを使用しているサイトでは、単純性と一貫性の両方の目的で、これらのパラメーターの使用を検討するよう推奨しています。
ここに記載されていないモデルを使用しているサイトでは、セクション3.6.4の要件を満たし、セクション4の考慮事項に適合するデータをもたらす独自の取得パラメーターを考案できるかもしれません。
場合によっては、イメージングプラットフォーム上で直接実装するための電子ファイルとして、パラメーターセットを利用することができかもしれません。
D.2.品質保証手順Quality Assurance Procedures
以下の表中で、特定のGE、Philips、SiemensのPET / CTスキャナーへの推奨品質保証の手順例が示されています。
| フィリップ社Gemin TF, V3.3とV3.4のためのQC手順とスケジュール | |||
| 装置 | QA手順 | 頻度 | |
| CT | Tubeキャリブレーション | 毎日 | |
| Airキャリブレーション | 毎日 | ||
| ノイズ ヘッドファントム上 | 毎日 | ||
| ノイズとアーチファクト。ボディファントム上 | 毎日 | ||
| コントラストスケールとアーチファクト | 月ごと | ||
| インパルス反応 | 必要に応じて高度試験 | ||
| スライス厚 | 必要に応じて高度試験 | ||
| PET | 毎日のPET CT | システム初期化 | 毎日 |
| ベースライン収集(すべての光電子増倍管チャネルのアナログオフセット) | 毎日 | ||
| PMTゲイン キャリブレーション | 毎日 | ||
| エネルギー試験と分析 | 毎日 | ||
| タイミング試験 | 毎日 | ||
| 排出サイノグラム収集と分析 | 毎日 | ||
| 自動QC | 自動システム初期化 | 毎日。毎日のQCを短くするために事前予定。 | |
| 自動ベースライン収集 | 毎日。毎日のQCを短くするために事前予定。 | ||
| 不定期チェック | 月ごと | ||
| SUVキャリブレーション | 6ヶ月ごと。再キャリブレーション後。SUV検証が乖離を生じた際。 | ||
| SUV 検証 | 2ヶ月ごと。PMが行われた際。 | ||
| GE社Discovery ST, STE, RxとDiscovery 600/700シリーズ PET/CTシステムズのためのQA手順とスケジュール | |||
| 装置 | QAの手順 | 頻度 | |
| コンピューター | システム リブート | 毎日or必要に応じて | |
| CT | CT管のウォームアップ | 毎日or休止後から2時間後 | |
| Airキャリブレーション(速計算) | 毎日 | ||
| ジェネレーター キャリブレーション | 毎日 | ||
| CT QA ファントム | コントラストスケール | 毎日スキャンを収集 | |
| 高度コントラスト空間分解 | 毎日スキャンを収集 | ||
| 低コントラストの検出可能性 | 毎日スキャンを収集 | ||
| ノイズと均一性 | 毎日スキャンを収集 | ||
| スライス厚 | 毎日スキャンを収集 | ||
| レーザーライトの正確性 | 毎日スキャンを収集 | ||
| 全システムのキャリブレーション | 管交換後or PMとして施行。 | ||
| PET | 日々のPET品質保証(DQA) | 一致性 | 毎日 |
| PET coincidence 平均 | 毎日 | ||
| PET coincidence 分散 | 毎日 | ||
| singles | 毎日 | ||
| PET singles 平均 | 毎日 | ||
| PET singles 分散 | 毎日 | ||
| デッドタイム | 毎日 | ||
| PET 平均 デッドタイム | 毎日 | ||
| タイミング | 毎日 | ||
| PETタイミング 平均 | 毎日 | ||
| エネルギー | 毎日 | ||
| PET エネルギーシフト | 毎日 | ||
| PET singles update gain | 週ごと | ||
| データベースの洗浄 | 週ごと | ||
| PET 2D 正規化 | 4半期ごと | ||
| PET 2D 十分なカウンター補正 | 4半期ごと(システムにとって適切であるならば) | ||
| PET 3D 正規化と十分なカウンター補正 | 4半期ごと(システムにとって適切であるならば) | ||
| 新規のDQAベースラインを確立 | 4半期ごと | ||
| ゲルマニウム-68源 ピン交換 | 18ヶ月ごと | ||
| シーメンス Biograph6/16 Hi-Rez, Biograph 16 Truepoint, Biograph16 Truepoint withTrueV, PET Syngo2010A, Biograph mCTのためのQA手順とスケジュール | |||
| 装置 | QAの手順 | 頻度 | |
| コンピューター | コンピューターの再起動 | スタートアップ時に毎日 | |
| スケジューラーの消去 | 毎日 | ||
| ネットワーク、ローカル、フィルム列の消去 | 1日4回 | ||
| 患者情報のアーカイブ | 毎日 | ||
| システムクリーンアップ/デフラグメンテーション | 週ごと | ||
| CT | CTチェックアップ/キャリブレーション | 毎日、フルロードの60分後、患者スキャンの1時間以内。 | |
| CT品質 | 水HU | 毎日 | |
| ピクセルノイズ | 毎日 | ||
| 管電圧 | 毎日 | ||
| PET | PET 日々のQC | 毎日の正規化 | 毎日 |
| PETキャリブレーションファクター(ECF)の計算と検証 | 毎日 | ||
| 正規化結果の表示とサイノグラム検査 | 毎日 | ||
| システム品質の報告 | 毎日 | ||
| 部分検出器のセットアップ:クリスタルリージョンマップ/エネルギー プロファイルの生成。 | 週ごと | ||
| フルディテクターのセットアップとタイムアライメント | 4半期ごと | ||
付録E:Common Data Format Mechanismに記録されるデータフィールド
以下のリストは、PET SUVsの定量的正確性(すなわち、既知および最小の不確実性)ために必要なメタ情報(すなわち、kBq / mlの画像値に加えて)を含みます。 ここでの目的は、メカニズムそのものではなく、どの情報を取り込むべきかを列挙することです。データの取り込み/提示の形式と対応するメカニズムは現在のところ規定されていませんが、 (例えば、PET / CTスキャナーまたは放射性核種キャリブレーターといった)補助測定装置から予め指定されたDICOMフィールドへの入力を指示するために、紙からスキャンされたフォームまたは電子データ記録までの範囲に及びます。 理想的には、指定されたすべてのメタデータは、PETイメージングのDICOMフォーマットを適切に変更した後、DICOMフィールドに直接電子入力することでキャプチャされます。ここで支持されている概念は、必要なメタデータが特定されているということです。 このプロファイル、DICOM標準、および技術の改訂を通じて、メタデータはより直接的な方法で分析ストリーム(図3)に挿入され、技術や受け入れられた標準は発展しています。
- 実行可能な範囲で必要な情報は、最も頻繁に変化しないものから、最も頻繁に変化する順にリスト化されます。
- すべての場合において、測定が直接的に行われるのか、推定されるのかに注意してください。 後者の場合は、情報源と日付と時刻に注意してください(例:被検者がベッドから移動して体重や身長を測定できない場合)。
記録されるデータフィールド:
1.サイト固有
a. サイト情報(名前および/または他の識別子を含む)
b. スキャナーの製造元とモデル
c. ハードウェアのバージョン番号
d. ソフトウェアのバージョン番号
e. 使用したスキャナーが以前に適格であったかどうかの確認
2. プロトコール固有
a. PET
ⅰ. ベッド1台あたりの滞在時間
ii. 獲得モード(3D)
iii. 再構成方法
b. CT技術(PET / CTスキャンの場合)
3. スキャナー固有QA / QC
a. 最新の較正係数(スキャナー)
b. スキャナーの毎日のチェック値
c. 最新のクロックチェック
d. 最新のスキャナーQA / QC
4. 被検者試験に固有
a. 重量(オプション)
b. 注入前後のアッセイ活性およびアッセイ時間
c. 注射時間
d. 注射部位(および浸潤の評価)
e. 正味の注入された活性度合(崩壊補正を含み計算)
f. 摂取時間
付録F:PETディスプレイの試験とUW-PET QIBA アミロイドDigital Reference Object(DRO)シリーズを用いた分析システム
ワシントン大学のQIBA PETアミロイドDROシリーズは、PET用の既知のボクセル値のDICOM画像ファイルを合成的に生成したセットです。PETデータは、単一被験者のMRIスキャン(DROシリーズで提供)から得ています。UW-PET QIBA DROシリーズは、PETアミロイド画像解析ワークステーション(IAW)による標準化された取り込み値比(SUVR)の計算を試ることを目的としています。これは、PETアミロイドIAWのベンダー固有の変動によって動機づけられます。UW-PET QIBA DROの開発 シリーズは、Quantitative Imaging Biomarker Alliance(QIBA)とワシントン大学によってサポートされています。
UW-PET QIBA DROシリーズの主な目標と目的は、QIBA PETアミロイドの「性能評価:画像解析ワークステーションとソフトウェア」のプロファイル開発の取り組みをサポートすることです。 これは、(1)標的および参照領域の配置の視覚的評価、(2)再現性および直線性に関するSUVR計算の評価および検証、および(3)IAWの製造業者が採用および変更できる共通の参照基準を提供すること。これら3点により行われます。
上記のように、UW-PET QIBA PETアミロイドDROシリーズは、患者の単一セグメントのMRIスキャンに基づいています。MRIスキャンでは頭蓋骨と皮膚をデジタル表記で取り除き、GM、WM、CSFに分割しました。これにより、これらの領域で異なるPET値をシミュレートすることが可能となりました。
図:どのようにDROシリーズが生み出されるか。
通常、測定システムはバイアス、直線性、再現性の評価と適合レベルを持っています。このプロファイル要求は(横断的要求とは対照的に)縦断的要求であり、各時点で同じイメージング方法を使用するため、バイアスを評価する必要はありません。したがって、ここで詳述される適合性評価は、直線性および再現性に焦点を当てています。
直線性
IAWの直線性は、様々なSUVR値によって定義されるように、様々な被験者の範囲を試験することによって評価されます。 以下の表は、シミュレートされた被検者、およびそれぞれのSUVR値についての詳細を示しています。CSF領域の活動性は0に設定されます。
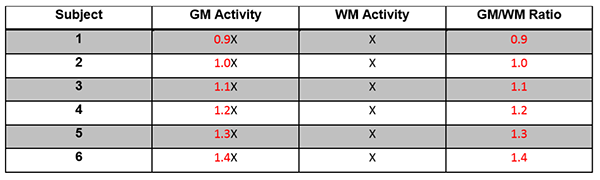
それ故、DROシリーズで6人の被検者がシミュレーションされていました。その後、IAWの直線性を試験するため、DROシリーズが使用されるでしょう。
再現性
IAWの再現性は、同じ被験者の複数回認識を評価することによって評価されます。これは、同じ被験者に対して複数回の試験・再試行をシミュレートするものと考えることができます。複数回認識は、典型的なレベルの臨床ノイズを各被験者に5回加えることによって行われます。以下の図を見てください。
DROシリーズ
6人の被験者のシミュレーションと5回の認識は、DROシリーズが30個のシミュレートされたPET容積を含むことを意味します。これらの容積DICOM形式で保存され、定量イメージングデータウェアハウス(QIDW)から以下のリンクを使用してダウンロードできます。
IAW適合性手順
a. QIDWからUW-PET QIBA PETアミロイドDROシリーズをダウンロードします。(準備が出来次第、リンクを提供します。)
b. 患者データが使用されるのと同様に、同じ手順、標的領域および参照領域を使用して、30容積を分析します。
c. 固定された基準領域に対する各ターゲット領域について、以下のグラフを形成する情報が計算されるべきであり、与えられたターゲットの結果と呼ばれるでしょう。 例:(前頭ターゲット/全脳参照ゾーン)
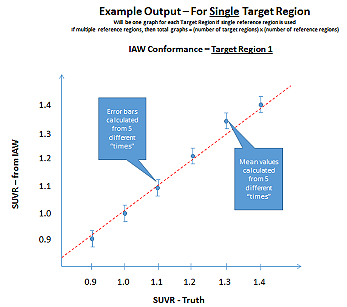
4.複数の参照領域を使用する場合は、この新しい参照領域を使用して、上記の3の場合と同じ情報が生成されます。ターゲット結果またはグラフの最終数は、(ターゲット領域の数)×(リファレンス領域の数)になります。
5.それぞれのターゲット結果に対して、以下の統計分析を実施する必要があります。
- Xi(YはIAWのSUV測定値、Xは実際のSUV測定値です)のYiの一般最小二乗(OLS)回 帰を適合させます。二次項が最初にモデルに含まれます:Y =βo+β1X+β2X2。 β0、β1およびβ2の推定値は、95%信頼区間(CI)とともに、評価記録の一部として報告されます(以下の最後の点を参照)。
- 線形モデルを再度当てはめます:Y = Ao + A1X(上のグラフの赤い点線)。
- A0とA1の推定値は、その95%信頼区間と共に、評価記録の一部として報告されます(以下の最後の点を参照してください)。
- 与えられた標的および参照領域にIAWが適合するために、R-2乗(R2)が0.90以上でなけ ればなりません。
- 6つの真のSUVR値ごとに、以下の式(合計はJ = 1からJ = 5 )を用いて、5つの測定値平均(青色の点)とwSD(上記グラフの青色エラーバー)を計算します。
- 等式を使用してwCVを推定すると、N = 6になります。
- 次式を使用して、%繰り返し精度(%RC)を推測します。
- 与えられた標的領域および参照領域に対してIAWが適合するため、%wCVは<2.6%でなければなりません。(IAWの%RCがプロファイル要求を満たしているという、この95%信頼区間は、この適合基準によって可能となっていることにご注意ください)。
- 今後の参考として、被験者数と被験者ごとの試験数は、DROシリーズで変更可能です。これにより、以下の表のごとくwCV%の閾値が変更されます。
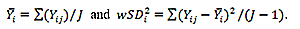
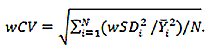
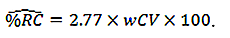
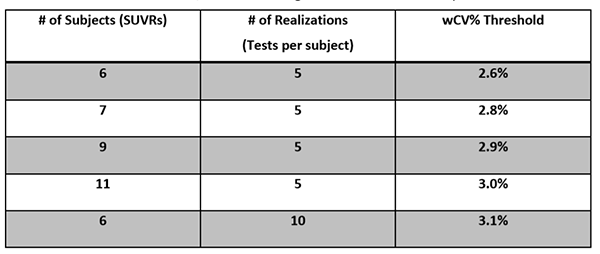
6.各ターゲットの結果ごとに、以下の表例のような形式で報告してください。
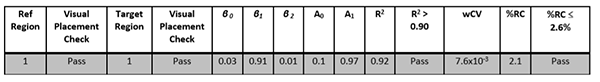
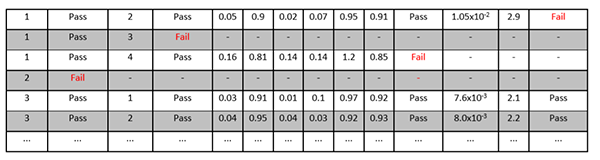
上記の表報告は、このプロファイルに準拠したPETアミロイド患者調査とともに保存し、アーカイブされる必要があります。
付録G:Hoffman Brain Phantomの最適な実践手引き
- 18-Fまたは18-FDGが加えられる前に、完全に満たされたファントムから始めてください(後述しますが、100ml以下です)。小さな気泡を取り除くのに、前日からファントムを水で満たすことが役立ちます。
- 精製水または蒸留水が好ましいですが、通常の水道水でも問題ありません。
- 充填する際は、完全に満たされたファントムが、ファントムをわずかに傾けることが役立ちます。(シリンジまたは同様の物品を片側の下にして、使用してください。)また完全に満たされたファントムが、充填の際の複数の充填口を開けるのに役立ちます。ファントムが完全に満たされたら、FDGを注入する前に50〜60ccシリンジを使用して75〜100mlを取り出してください。これにより、より良い混合が可能となります。
- 3〜5mlの量でF18トレーサー(典型的にはFDG)を準備してください。これは撮影時の予定時刻時に注入量0.5〜0.6mCi(18.5〜22.2MBq)になるように補正されています。
- シリンジの針を長く鈍い先端針に切り替えます。針の先端がファントムを通ってほぼ半分になるまで、充填口上部(脳の前側)を通して針を挿入します。シリンジを2〜3回すすぎ、シリンジ内の残留物を減らします。
- 元の(短い)針にトレーサーが残っていないことを確認するため、その針を取り付け、さらに2〜3回すすいでください。
- ニードルとシリンジの残留量を測定してください。投与量キャリブレーターの汚染を防ぐため、投薬キャリブレーターに入れる前に、これらを手術用手袋に入れることをお勧めします。
- 注入したら、キャップを交換し、約5分間激しく前後に撹拌してください。場合によっては、つまんで反対方向に上下に傾けます。
- できるだけ早く、1〜2つのポート(気泡があるところ)を充填してください。
- 2回目は1分間ほど軽く行います。こうすることで泡を取り除くのに役立ちます。
- 2回目の充填です。 ここで重要なのは、残っている気泡を取り除くことです。泡を上昇させるために効果的な方法は、(充填口を上にして)直立させ、激しく前後に振ることです。(こぼれを最小限に抑えるため、充填するときに覚えておいてください。ペーパータオルで拭くと放射性廃棄物になります。)
- 最後の3回目の撹拌です。上に残っている気泡を取り除くため、再び充填してください。
- 最後のチェックとして、明るい光をかざしてファントムの気泡を確認します。
大きな気泡(〜3 mm以上)がある場合は、追加の振動/タッピング/撹拌/充填の工程を試みます。 - CTスキャンを行い、大きな気泡や気腔があることに気づいたら、最終のCT /PETスキャンを行う前に、ファントムを取り出し、気泡除去を試みてください。

一般的に、この過程には約10〜20分かかります。

ベッドの足元に充填口を向け、また前方充填口を12時の位置にして、ファントムをスキャナベッド上に配置してください。(この位置では、小脳葉はファントム底部に表示され、また仰臥位になった被験者をイメージした再構成画像が現れます)。
付録H:ホフマン ファントム データ分析の詳細例
定量分析の基本的な方法は、アフィン登録を使用し、テストスキャンをデジタルアトラスにアライメントした後、データの強度正規化を行い、最後にテストスキャンの空間分解能に最適なデジタルアトラスのスムージング係数を見つけることです。 一旦データが登録されると、強度正規化テスト画像および平滑化されたゴールドスタンダードが計算されます。また全体のスキャン品質を評価するため、差異画像が視覚的に観察され、以下に記載される様々な方法によって定量化されます。
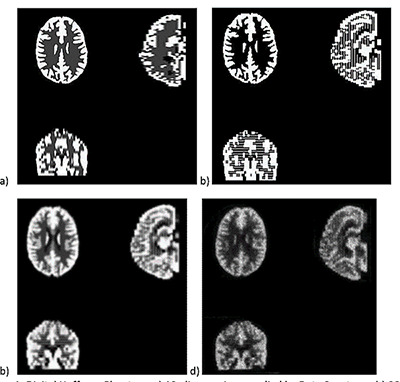
図1. デジタル ホフマン ファントム
a)データ・スペクトルによって供給された19スライス・バージョン。b)各スライスの個々のレイヤーをより正確にモデル化した90スライス・バージョン。c)90スライスのデジタルファントムの平滑化されたバージョン。 d)高解像度HRRTスキャナーから得られたリアルファントムデータの例。
ファントムの説明
ホフマン脳ファントムの内部は、厚さ6.1mmの19種類のプレキシガラスプレートで構成されています。放射性同位元素溶液の均一濃度が移動することで、4:1 灰白質:白質の取り込み比を達成するため、各プレートは、8つの別々の層からなる「サンドイッチ」で構成されています。層のそれぞれは、モデル化された灰白質の形に切り取られた「灰色」スライス(G)、およびモデル化された白質の形に切り取られた「白色」スライス(W)で構成されています。CSFの領域は完全に空白のままです。従って各層は、この順序の「サンドイッチ」で構成されています:GG | W | GG | W | GG。最も尾側のスライスと最も頭側のスライスは、わずか4つの灰色の層(GG | GG)から構成されています。
ファントムを製造しているData Spectrum社は、6.1mmスライスごとに3種類の均一領域(グレー= 4、ホワイト= 1、csf = 0)の1つを示すよう、ファントム外観をモデル化した256×256×19ボクセルのデジタルアトラスを提供しています。図1aを参照してください。ミシガン大学のBob Koeppe博士は、Data SpectrumとCTI(現在のSiemens)と協力して、スライス間の個々のレイヤーをモデル化する、160 x 160 x 90ボクセル、1.548 x 1.548 x 1.548mmのより正確なファントムバージョンを構築しました。この90スライス ファントムの各スライスには、0または1.0の値を有するすべての灰色層「GG」か、 0、0.5、1.0のいずれかの値を持つ 「GW」層があります。このデジタルファントム(図1b、c)は、高解像度PETスキャナー(図1d)から得られたデータに非常によく似ており、また低解像度スキャナーからの画像を近似するために、平滑化されます。個々のレイヤーは、Siemens HRRTなどの一部の高解像度スキャナーで実際に見ることができます。
注目すべき重要な項目の1つは、実際のファントムサイズ、特に各ファントムの実際の物理的なスライス厚が、わずかに変わる可能性があることです。したがって、データを比較するときは、スケーリングを用いて適切に処理することが重要です。あるいは、2つの取得間で比較が行われる場合、比較において同一のファントムが使用されることを保証しなければなりません。複数のファントムが使用されている場合は、それぞれのファントムを適切な識別番号で追跡することをお勧めします。
平滑化に関しては、同じ大きさの軸方向(すなわち、xおよびy方向)および別軸方向(z方向)のガウスカーネルを用いた平滑化によって、PETスキャナーの解像度をモデル化することが可能と想定されます。ぶれは中心から遠ざかるほど大きくなり、半径方向と接線方向では異なるため、これはおおよその値です。また、軸方向分解能は、スキャナーの外側端面で低下します。しかしながら、FOVがスキャナー中心にかなり近い頭部画像において、均一な平滑化想定はかなり妥当なものとなります。
方法とメトリック
方法の概要
定量分析の方法は、以下のステップに要約することができます。
1) 単一の平均PET体積を生み出す「ソース画像」取得と呼ばれる、ダイナミックPET検査画像を合計します。
2) アフィン変換を使用して、平均化されたソース画像を90スライスのデジタル基準として登録します。
3) デジタルファントムに適用させ、登録後のソースデータセットと最もよく一致させるため、ガウス平滑化係数 FHWMxy、FWHMzを決定します。
4) マッチした平滑な "ゴールドスタンダード"データと登録後のソースデータとの差異に関するイメージメトリックを計算します。
5) 画像品質を視覚的に評価するため、さまざまな画像とグラフィックスを作成します。
関連データファイル
分析には、以下の入力ファイルと参照ファイルが使用されます。
参照ファイル
ctiHoffman0.0_0.0.nii - 160x160x90のデジタルゴールドスタンダードデータです。
ctiHoffman5.0_5.0.nii - これは、x、y、zの次元でガウスカーネルの5.0 mm FWHMで平滑化されたctiHoffman0.0_0.0.niiです。これは、HRRTなどの最高解像度スキャナーの解像度に近い画像を提供します。
HoffmanVOI5mm6Level.25_.95BrainMask.nii - これは、平滑化されたファントムファイルctiHoffman5.0_5.0.niiのマルチレベル閾値処理を使用して、PMODで作成された6つのレベルの関心ボリューム(VOI)マスクファイルです。結果として得られるセグメンテーションが図2に示されています。CSF、白質および灰白質の理想化されたボクセル強度は、それぞれ0.0, 0.025, 1.0であるが、デジタルファントムのぼかしは部分体積効果をもたらし、その結果ボクセル値は0.0〜1.0の間で連続的に変化します。領域は、以下のIDおよび閾値基準で定義されました。
主に白質および灰白質の領域をそれぞれ表す領域4および6は、分析における比較のために使用される主要領域です。
図2. 6領域の関心領域ボリューム。
平滑化されたデジタル基準(左)とマルチスレショールドセグメンテーション(右)を使用して、PMOD内に作られた関心領域マスクボリュームです。VOIマスクは、主に純粋な灰白質(赤色で示す)および純粋な白質(緑色で示す)を表す領域を定義するために使用されています。これらの領域は、画像強度正規化および様々な画像品質メトリックのために使用されています。
入力ファイル
SourceXXX - 元となるダイナミックPETデータ。 通常はDICOM形式で、そしてこのプロファイルの場合は4 x 5の緻密な取得が推奨されています。
中間ファイル
平均SourceXXX.nii - 合計されたダイナミックデータ。
RegSourceXXX.nii - 160x160x90ボクセルデジタルファントムテンプレートに登録された合計ダイナミックデータ
RegSourceNorm.nii - 0〜1.0の値に正規化されたRegSourceXXX.niiのバージョン。
出力ファイル
ボリューム
RegSourceXXXFit.nii - ホフマンデジタルテンプレートctiHoffman0.0_0.0.niiの平滑化バージョン。RegSourceNorm.niiに最も適しています。
RegSourceXXXAbsDiff.nii - RegSourceFit.niiとの間で、絶対的差異容積を示します。
テキスト
RegSourceXXXfit.txt - サマリ出力ファイル
JPG - 1753
RegSourceXXXXplotAbsDiffProfile.jpg – profile of
RegSourceXXXXplotGrayWhiteProfile.jpg -
RegSourceXXXXplotImgDiff.jpg - central three orthogonal planes through RegSourceXXXAbsDiff.nii, gray scale set between -0.2 and 0.2.
RegSourceXXXXplotImgNorm.jpg – central three orthogonal planes through RegSourceNorm.nii, gray scale
set between 0.0 and 1.0
メソッドの詳細 - 処理ステップ
1)マニュアル ステップ:画像データのロード/視覚チェック。POMDバッチファイルリストへの追加
向きが正しいことを視覚的に確認するため、手動でロードされる必要のあるPMODバッチファイルリスト画像を追加してください。画像がデフォルトパラメータを使用してロードされる場合、後のバッチ処理のため、画像をPMODファイルリストに追加することは簡単です。デフォルトの設定がうまくいかない場合、画像を正しい方向に再設定するスイッチを使用することにより手動でロードされ、新しいダイナミックファイルとして保存され、その後PMODバッチファイルリストに追加されなければなりません。
2)バッチステップ:PMODスクリプト:動的平均化、ホフマン デジタル参照へのアフィン登録
このステップは、平均化されたPETソースファイルを得るために、ダイナミックPETデータを合計し、次いで平均化されたPETをホフマン参照画像に登録します。画像の時間フレーム間には動きがないと仮定がされているので、患者研究で行う場合のように、モーション補正ステップは必要ではありません。参照画像として、5mmの等方性ガウスフィルタで平滑化されたホフマン基準のバージョンが使用されています(ctiHoffman5.0_5.0.nii)。これは、最高解像度のPETスキャナーから予測される画像の解像度を表しています。PMODの登録モジュールでは、標準化された相互情報と「スケール」オプションが選択され、わずかに異なるファントム原寸大サイズを補正するアフィンマッチングが可能となります。登録中には、他のプレ・スムージングは使用されません。バッチ処理では、平均化データセットと登録済みのデータセットを2つの別々のファイルとして保存します。このステップは、1つまたは多くの異なるPETファイル上で実行可能です。PMODは、再オリエンテーション マトリックスを記録するようにまだ設定されていないので(私はこれを要求していますが)、我々は全操作の全トラックを把握していません。
3)バッチステップ:Matlabスクリプト:PETの正規化、平滑化モデルの適合、差分画像の定量化
一旦PETソースがホフマン参照に登録されると、matlabスクリプトが使われ、以下のステップが実行されます。
- 登録されたPETソース強度の標準化。ノイズのないデジタルファントムは、0.0〜1.0の範囲の値を有します。ソース画像を最大強度まで正規化するよりむしろ、部分容積効果および灰白質および白質領域の期待値に対する平均値周辺の予想ポアソン関連変動を調整する、以下の手法が採用されます。 6段階のVOIマスクを使用して、ほとんどが純粋な灰白質を表す領域6を参照領域として使用します。この領域内のボクセル値平均強度は、平滑化された参照ボリュームと登録されたソースボリュームの両方で計算されます。 スケール項は、灰白質領域の参照体積平均強度/灰白質領域のソース体積平均強度の比として計算されます。これは、純粋な灰白質を表す領域の平均値をもたらし、これは正規化画像でボクセル強度1.0に設定されます。
- ガウス平滑化カーネル、FWHMxyおよびFWHMzを適合させます。 非拘束型の非線形推定アプローチは、ガウス平滑化カーネルを見つけるために使用されます。ガウス平滑化カーネルは、正規化されたソースボリュームに最もよく適合するデジタル参照ファントムの平滑化バージョンを生み出します。(Matlabの "fminsearch"関数を使用しています)。絶対差、二乗差、相関、脳マスクした差といった様々な画像差測定法を調べました。この結果、単純な絶対差が上手に機能するように見えました。 これらオプションのいずれかを選択できるように、規約には記載されていますが、デフォルトでは絶対差が用いられています。
2)正規化されたソース画像と差分画像からの品質メトリックの計算
標準化されたソース画像と、ソース画像に適合するように平滑化されたデジタル参照画像との間の差異が、比較のための主な基礎になります。 さらに、正規化されたソース画像のみから、いくつかの尺度が計算されています。 この分析で考慮すべき基本的な考え方は次のとおりです。
- 完全な空間分解能のノイズフリー設定下では、理想的な灰白質:白質のコントラスト比を4:1にする必要があります。部分音量効果を考慮する必要があるため、ノイズのない平滑化されたデジタル参照画像の全体像またはVOI測定との比較のもとで、ほとんどの評価が行われます。
- 均一なファントムを使用する評価の場合、許容可能な測定分散の通常の性能指数は、面内および軸方向の平均から±10%です。 したがって、約10%の絶対差、すなわち±0.1強度単位は、理想的には、正規化されたソース画像と平滑化された参照画像との間の最大差となります。
品質指標
a)グローバルボリュームメトリック
- フィットスムージングパラメータとADNI / Bob Koeppeグループの公開データとの比較。この値は、指定されたスキャナーの種類によって一貫している必要があります。 ADNI結果と比較したZスムージングの差異は、アフィン登録過程中のZスケーリングに主に起因すると予想されます。 経験的観察に基づくと、フィット平滑化パラメーターが1mm FWHMを超えて異なる場合、問題が生じる可能性が最も高いです。
- 平均グローバル絶対差 - 総イメージボリューム:理想的には、これは10%未満でなければなりません。それゆえ0.0〜1.0の値に正規化された画像強度で0.1未満となります。
- 脳領域のみの平均グローバル絶対差:理想的には、これは0.1未満でなければなりません。それゆえ、画像強度が0.0と1.0との間の値に正規化された場合、0.1未満となります。
- 灰白質:元画像の白質比。理想的には、これは4.0です。解像度の低いスキャナーでは、値がより小さくなることが予想されます。
- 灰白質比:平滑化基準画像との比較で、元画像内の白質領域。理想的には、これは1.0にする必要があります。 多くても10%の変動が予想されます。
- 平滑化された参照画像と比較した、元画像における白質の強度標準偏差の比:この測定は画像ノイズの指標を与えてくれます。基準体積と比較することにより、部分体積効果による白質領域の変動が相殺されるはずです。
- 平滑化された参照画像と比較した、元画像における灰白質の強度標準偏差の比:この測定は画像ノイズの指標を与えてくれます。基準体積と比較することにより、部分体積効果による白質領域の変動が相殺されるはずです。
b)スライスごとのメトリック(平面10-80間で計算されたもの。Hoffman基準体積で脳データの平面を表します。)
- 平均スライス絶対差 - 全スライス:理想的には、これは、10%未満であるべきです。それゆえ、画像強度が0.0と1.0との間の値に正規化された場合、0.1以下です。
- 平均スライス絶対差 - 脳領域のみ:理想的には、10%未満であるべきです。それゆえ、画像強度が0.0と1.0の間の値に正規化された場合、0.1以下です。
- 平均スライス絶対差 - 灰白質のみ(VOI領域#6):理想的には、これは10%未満であるべきです。それゆえ画像強度が0.0と1.0との間の値に正規化される場合、0.1以下です。
- 平均スライス絶対差 - 白質のみ(VOI領域#4):理想的には、10%未満であるべきです。それゆえ、画像強度が0.0と1.0との間の値で正規化される場合、これは0.1以下です。
- 元画像に対するVOI領域#6の平均灰白質強度の平滑化基準との比:理想的には、これは1.0であるべきです。
- 元画像に対するVOI領域#6の平均白輝度の平滑化基準との比。理想的には、これは1.0であるべきです。
- 灰白質スライス平均白質強度のプロファイル係数。このメトリックは、軸方向の感度で、許容できない変動のセンチネルとして使用されます。
3)出力:グラフィックス、テキスト要約および画像ボリューム
a)JPG
- 差ボリュームの中心を通る、3つの直交スライス - 基準ボリュームとは異なる重要な領域を強調表示するために、すべての評価で±0.2に設定されたカラーバー。
- 正規化および登録されたソースボリュームを通る3つの直交スライス
- ソースボリュームと参照ボリューム間のエラー測定値のスライスごとのプロファイル
- 基準体積と比較して、元体積に対する平均灰白質領域と白質領域の強度比のスライスごとのプロファイル。
b)テキストファイル
i)グローバルおよび平面ごとのメトリックのための数値
c)画像体積
i)差の体積
ii)平滑化された参照体積をフィットさせる
注:使用されるMatlabモジュール。 Matlabの基本パッケージに加えて、標準のMatlab Image Processing ToolboxとOptimization Toolboxを使用した処理パイプライン。 このパイプラインはまた、NIFTIファイルの読み込み用、書き込み用、表示用の第三者Matlabパッケージも使用していました。
「Tools for NIfTI and ANALYZE image」(http://www.rotman-baycrest.on.ca/~jimmy/NIfTI)
Figure 3. Affine Registration Process. Source image in original orientation (a). Source image (colored grayscale, and digital gold standard (grayscale) unregistered (b), and after registration in PMOD (c).
ADNI Hoffman の資格データを使用した結果例
例1 良質なスキャン。 シーメンス HIREZ(037_P_0001)
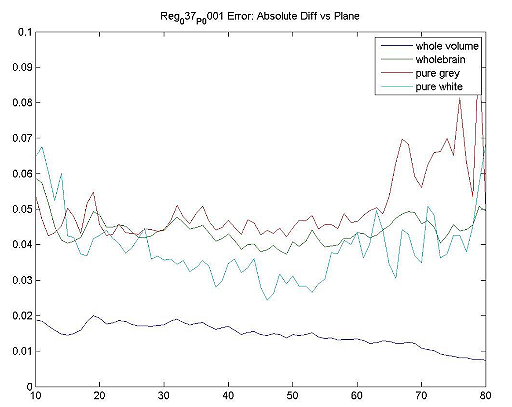
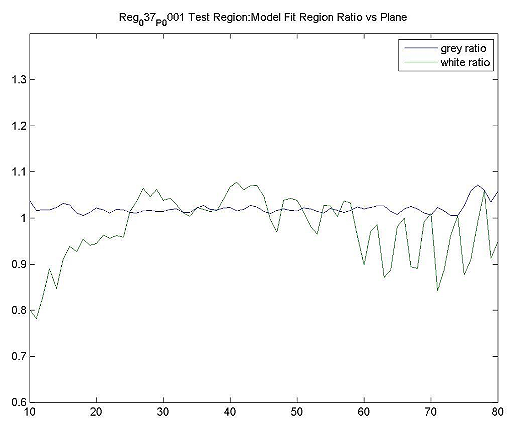
例2 良質スキャンの別例。 ECAT HR +(006_P_0001)
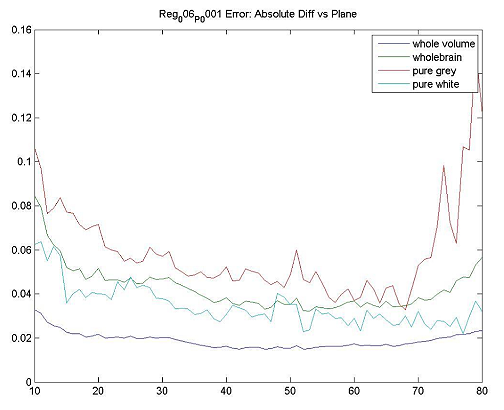
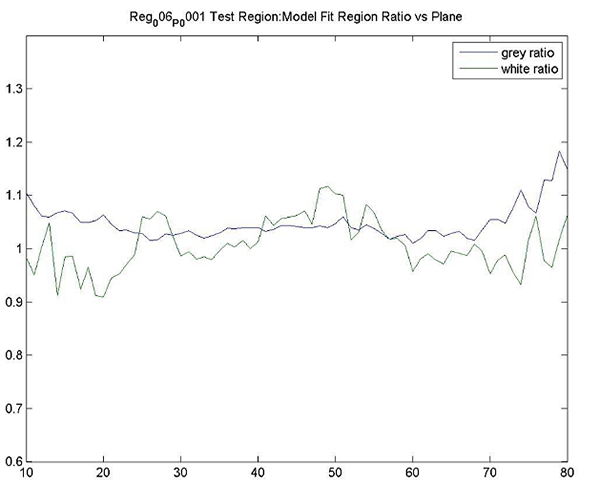
例3 シーメンスECAT Accel(098_P_0002)。 画像品質が比較的悪い例。左右間に見られる非対称性、および平面30と50の間の大きな誤差が含まれます。しかし、これはスキャン品質が低いか、またはプレキシガラス平面の間に余分なスペースを持つホフマンのファントムによる要因でしょうか?
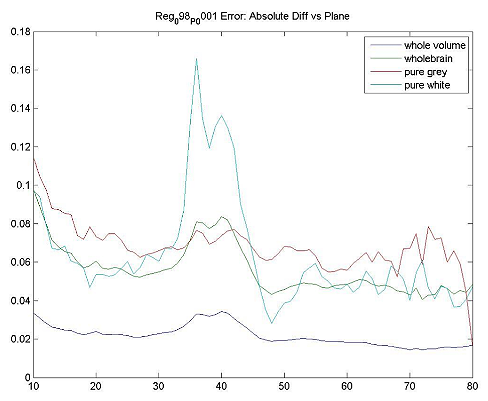
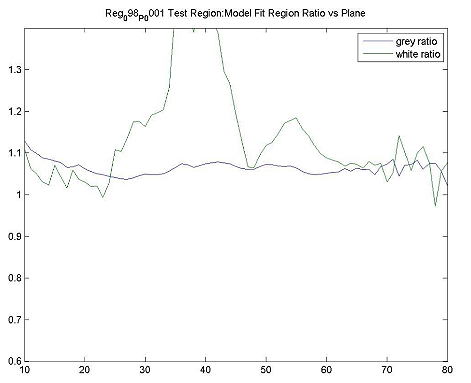
例4。 HRRTの例(128_P_0001)。たいていの場合、散乱補正の問題が原因で、ボトムのパフォーマンスが低下します。それ以外の場合は、スキャンの品質はかなり良好です。大部分の脳の差分画像は、陰性(青色領域)です。これはおそらく、平面下部の高い強度によって、あまりにも低く操作されてしまった全体画像の強度正規化によるものです。
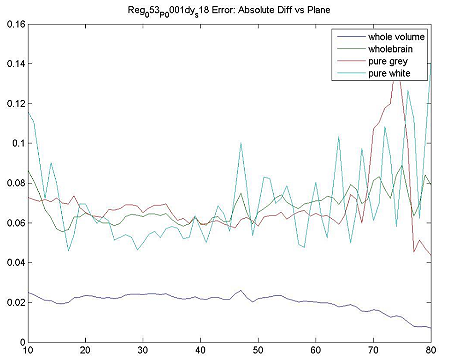
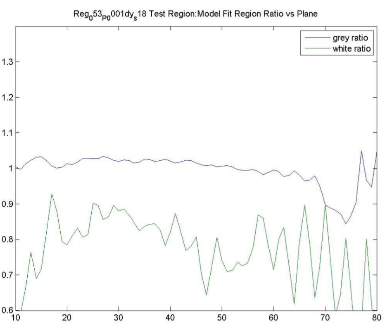
例5 (136_P_0004) - GEディスカバリST。品質不良 - おそらく失敗する可能性があります。前頭葉領域の非常に大きな誤差。参照領域と比べ白質の値は非常に高値です。