Japan Quantitative Imaging Biomarker Alliance (J-QIBA)
Quantitative Imaging Biomarker
Small Lung Nodule
QIBA プロファイル:
低線量検診CTにおける肺の小結節の体積計測と経過観察
- 日本語訳作成:
- 秦 明典,富山 憲幸
目次
解決済みの問題
1.エグゼクティブサマリー
2.臨床的背景と要件
3.プロファイルアクティビティ
3.1. 製品の検証
3.2. スタッフの質的評価
3.3. 装置の質的評価
3.4. プロトコールデザイン
3.5. 被験者の選択
3.6. 被験者の取り扱い
3.7. 画像データの取得
3.8. 画像データ再構成
3.9. 画質評価
3.10. 画像解析
4. 適合性評価
4.1. 技術的評価方法
4.2. 装置ベンダーによる適合性評価手順
4.3. 実施施設での適合性チェックリスト
参考文献
Appendix
Appendix A:謝辞と帰属
Appendix B:背景
B1 結節体積計測のaccuracyに関する参考文献のサマリー
B2 結節体積計測のprecisionに関する参考文献のサマリー
Appendix C:計量学的手法に関する参考文献
解決済みの問題:
下記の問題はバイオマーカー委員会によって解決されたと判断されたもので、再度の議論を防ぎ、解決の背景となる事項の記録を提供するために提示されている。
Q. PSFはCT画像の分解能を評価する指標の一つであるが、CT medical physics communityで使用されている指標は他にもある (MTF 50など) 。このプロファイルではそのような指標の使用は容認されるか?
A. このプロファイルの現バージョンでは、分解能の指標には主にPSFを用いている。しかし、PSFとMTF 50を相互変換する公式も紹介されている。今後のバージョンでは、 このプロファイルの多くの部分で PSFと MTF 50の両方を提案する可能性がある。
Q. CT装置やプロトコールの性能評価において、HUバイアスとノイズの計測のために空気、アクリル、デルリン、テフロンの四つの物質のファントムを使うことは過剰ではないか。このプロファイルでは、これらの物質のいくつかを省略することが可能か?
A. 肺結節体積計測におけるHUバイアスの影響を評価するために使う物質は4つ未満でよいと合意されている。使われる物質は空気とアクリルの2つが主流である。というのも、肺の充実性結節の計測は主に、背景肺実質(主に空気で構成される)と結節組織(水のHUと同等で、アクリルのHUと近い)の濃度勾配を用いてセグメンテーションを行うからである。そのため、これらの2つの物質間のHUバイアスが大きい場合、肺結節体積計測の性能は大きく影響を受けてしまう可能性がある。このプロファイルでは、空気とアクリルのHUバイアスと、アクリルにおけるノイズに上限を設けるよう修正された。しかし、他の物質においてもHUバイアスとノイズが大きい場合、肺結節計測に影響を与えるようなアーチファクトを生じる可能性がある。HUバイアスとノイズを計測するための最適な物質の選定は、現在提案されているファントムや他のQIBA承認ファントムでのデータ集積が行われることで、将来のバージョンで改定される予定である。
Q. CT装置、画像再構成法、病変の形状は様々である。これに対応して評価を行うためにはさらなるデータと研究が必要である。このプロファイルは、提案された方法が様々な状況で行われるのに適切かどうか確認するために、追加の研究を行う可能性があるか?
A. 提案されたファントムやその他のQIBA承認ファントムで、 追加のデータ集積の研究を行う予定である。それによって、このプロファイルのエビデンスに基づいた調整が行われる。
Q. このプロファイルではエッジ強調(Edge Enhancement)や空間歪み(Spatial Warping)に上限を設けている。これらの指標は、 肺の充実性結節の計測性の評価に必要か?
A. 空間歪み(Spatial Warping)は肺の充実性結節の計測の変動を大きくするという報告がされている (Henschke, et al., JMI 2016, https://www.ncbi.nlm.nih.gov/pubmed/27660808) 。一般的に用いられているセグメンテーションアルゴリズムにおいて、エッジ強調(Edge Enhancement)は濃度勾配に等方向性でない影響を与え、結節のセグメンテーションをより困難にすることが知られている。また、エッジ強調(Edge Enhancement)はCT装置の本来の分解能の推定にバイアスを与える。CT装置の分解能は肺の充実性結節計測の性能を大きく左右する。それでもやはり、現在の要件は過剰である可能性はある。現時点でのこの要件における仕様は、現在提案されているファントムや他のQIBA承認ファントムでのデータ集積が行われることで、さらに評価される予定である。また、計測手法については、図を用いた記述を追加するなど、さらなる改訂が行われる予定である。
Q. このテンプレートは将来の改訂においても利用可能か?
A. 利用可能である。改訂は反復的なプロセスである。問題点や新しい提案、アイデアをQIBA委員会に提示することが推奨される。
1. エグゼクティブサマリー
QIBAプロファイルの目標は、バイオマーカーとしての十分な性能を達成することを支援することにある。
Section2 要件(Claim)には、バイオマーカーとしての性能が記述してある。
Section3 プロファイルアクティビティには、バイオマーカーの生成について書かれている。要件を達成するために必要なアクティビティを行うアクターについての必要条件(requirement)が示されている。
Section4 評価手順には、プロファイルの必要条件への適合性評価に使われる技術的な方法が定義されている。これには実施施設と装置ベンダーのステップが含まれている。
このQIBAプロファイル(低線量検診CTにおける肺の小結節の体積計測と経過観察)は、直径6~10 mmの充実性肺結節に適用される定量的CT体積計測のaccuracyとprecisionについて記述されている。このプロファイルでは、定期的な装置の質的評価、被験者の選択、被験者の取り扱い、画像データの取得、画像データ再構成、画質評価、画像解析といったアクティビティに携わるCT装置、放射線技師、放射線科医、画像解析ツールの必要条件が規定されている。
この必要条件は、肺結節体積計測における十分なaccuracyを達成し、望ましくない変動を避けることに焦点をあてている。
このプロファイルの中では、2つの要件が提示されている。1つ目の要件は、充実性肺結節のベースラインでの計測における、6~10 mmのサイズごとの95%信頼区間を確立している。2つ目の要件では、結節の真の変化として、95%の信頼性で判断できる変化率の手引きを提供している。また、2つの時点における結節のサイズに基づいたサイズ変化の95%信頼区間の手引きも提供している。
この文書は、臨床医がバイオマーカーとしての信頼性をもって肺の結節体積を計測できるようにすること、画像部門のスタッフがバイオマーカーを生成できるようにすること、装置ベンダーが関連する製品を開発できるようにすること、それらの製品の購入者や研究者が画像をエンドポイントとした臨床試験のデザインをすることができるようにすること、を支援する意図で書かれている。
このプロファイルは、要件を達成するための必要条件を記述するものであって、「standard of care (標準的なケア)の必要条件」について記述するものではない。また、このプロファイルへの適合性は、患者の適切なケアのためには二次的なものである。
このプロファイルは、実施施設で使われるCT 装置の基本的な画像特性を評価するための、ファントムを用いた適合性テストに関する記述を含んでいる。適合性評価を行うために必要なステップがこのプロファイルに記載されており、CT装置がこのプロファイルの要件のための必要条件をみたすための正確性を十分に持っているかどうか判断できるようになっている。
CT、MRI、PET、超音波を使ったその他の画像バイオマーカーのためのQIBAプロファイルは、qibawiki.rsna.org.で参照可能である。
2. 臨床的背景と要件
臨床的背景
このプロファイルでは長径6~10 mmの充実性肺結節の定量的体積計測、および体積変化計測を想定している。長径10 mm以上(体積では524mm3以上)の結節・腫瘤の対象については、QIBAプロファイル–CT腫瘍体積変化(CTV-1)に記載されている。
全ての関連するスタッフと装置が以下の要件(Claim)を満たした場合にこのプロファイルに適合するものとする。
要件1:結節体積
計測された結節の体積YとTable 1における対応する変動係数CVに対して、真の結節体積の95%信頼区間が、Y±(1.96×Y×CV)になること。
要件2:結節体積変化
(a)計測された結節体積変化率Xに対して、X > (2.77×CV1×100)の場合に、95%信頼性をもって真の結節体積変化が生じること。
(b)2つの時点の計測された体積をY1およびY2とし、Table 1における対応する変動係数をCV1、CV2とすると、体積変化の95%信頼区間がZ = (Y2-Y1)±1.96×√([Y1×CV1]2+[Y2×CV2]2)となること。
これらの要件は下記の場合に有効である:
- 結節が完全に充実性であること
- 横断面(axial断面)での結節の長径が6 mm (体積では113mm3)から10 mm (905mm3)であること
- どの断面方向であっても結節の短径は長径の60%より大きい(結節の形状が球形から大きく逸脱しない)こと
- 2つの時点の両方で結節の計測が可能である(結節の周囲に同様のCT値の構造がなく境界が明瞭である、幾何学的に単純な形状でマニュアルでの修正が必要なくソフトウェアで自動計測できる、など)こと
- Table 1に提示された変動係数の間の値がinterpolation(補完)によって得られること
Table 1. 変動係数 (CV) 対応表
| 結節の直径(mm) | 結節の体積(mm3) | 変動係数(CV) | 真の体積の 95%信頼区間(mm3) |
検出可能な最小の変化 (要件2a) |
|---|---|---|---|---|
| 6 mm | 113 | 0.29 | ± 64 | 80.3% |
| 7 mm | 154 | 0.23 | ± 69 | 63.7% |
| 8 mm | 268 | 0.19 | ± 100 | 52.6% |
| 9 mm | 382 | 0.16 | ± 120 | 44.3% |
| 10 mm | 524 | 0.14 | ± 144 | 38.8% |
| 11 mm | 697 | 0.12 | ± 164 | 33.2% |
| 12 mm | 905 | 0.11 | ± 195 | 30.5% |
考察
低線量CTは、肺結節を検出し、経過観察する有効な方法である。そして肺癌のハイリスク患者において、生存率を増加させ、死亡率を低下させることが報告されている(1,2)。経時的なサイズの定量評価は、肺結節が良性か悪性か判断する際に有用な指標となる。現時点では、結節の計測は、axial断面での直行2方向の平均値によってなされるのが主流である。これまでの研究によって、結節全体の自動計測によって、マニュアルによる径の計測の問題点が解決されることが報告されている(3-9)。そして、ファントム(10-18)や生体(19-25)で、CT体積計測の手法が多くの研究によって探索されている。この文書は、低線量CTと結節の経過観察時の、充実性肺結節の体積計測における、再現性が高く標準的な計測法を提示している。
CT肺癌検診はプロトコール作成の難しい部分がある。肺結節の検出と診断を正確に行うメリットと、20年以上にわたって毎年の検診を無症状の被験者に行うことによる放射線被曝のリスクのバランスをとることである。
放射線量を最も低くした場合にはノイズが増加し、正確な計測ができなくなってしまうという問題点がある。それゆえ、これらの相反する条件は全てのプロトコールに関わる問題である。
このQIBAプロファイルは、ここに示された画像データの取得、処理、解析の条件のもとで、肺結節の体積とその変化率が信頼性をもって計測するための要件を定義し、利用者と製品開発者が目標とされるレベルの性能を達成できるようにするために採用されるべき仕様を提示している。この文書の対象は、下記に挙げるような医療の専門家とその他の肺癌検診における関係者である。
- CT検診のプロトコールをデザインする放射線科医、放射線技師、物理士
- 新しいCT装置を調達するための条件を検討する放射線科医、放射線技師、物理士、実施施設関係者
- ソフトウェアや装置開発にかかわる技術的スタッフ
- 医薬品企業
- 検診に関わる臨床医
- 臨床試験に携わる関係者
- CT画像を用いた定量評価を行う放射線科医やその他の医療関係者
- 画像定量値を用いて判断を行う腫瘍医、規制当局、専門学会など
- 肺癌検診の導入を検討する放射線科医、医療関係者、政府関係者
必要条件として記載されている仕様は、単に要件を達成するための必要条件であって「standard of care(標準的なケア)の必要条件」ではない。また、このプロファイルへの適合性は、患者の適切なケアのためには二次的なものである。
このプロファイルはCT肺癌検診に参加する無症状の被験者に関するものであるが、理論的には、このプロファイルでのアクティビティはその他の状況での、既知のもしくは偶然発見された径6~10 mmの充実性肺結節にも適用されうる。
要件1(結節体積)の臨床的解釈
結節の真のサイズは計測された体積と95%信頼区間で定義される。信頼区間は「エラーバー」、「不確実性」、計測に関わる「ノイズ」であり、結節の真の体積はこの信頼区間のどこかにあると考えられる。
実際の適用例を以下に示す。
例1:
結節が計測されて、その体積は150mm3(直径6.6 mm) であった。95%の信頼性で結節の真の体積は65 mm3 [150 – (150 × 1.96 × 0.29)] (直径5.0 mm)~235 mm3 [150 + (150 × 1.96 × 0.29)] (直径7.7 mm)の間にあると考えられる。
例2:
結節が計測されて、体積は500 mm3(直径9.8 mm)であった。95%の信頼性で、結節の真の体積は343 mm3 [500 – (500 × 1.96 × 0.16)] (直径8.7 mm)~657 mm3 [500 + (500 × 1.96 × 0.16)] (直径10.8 mm)の間にあると考えられる。
例3:
結節が計測されて、体積は800 mm3(直径11.5mm)であった。95%の信頼性で、結節の真の体積は612 mm3 [800 – (800 × 1.96 × 0.12)] (直径10.5 mm)~988 mm3 [800 + (800 × 1.96 × 0.12)] (直径12.4 mm)の間にあると考えられる。
プロファイルの仕様通りにアクティビティが行われれば、それぞれのサイズの結節の体積計測結果は95%の信頼性をもって正確と考えられる。結節のサイズが異なる場合に異なる変動係数を用いるのは、装置の分解能の限界によって変動が増加し、このプロファイルの仕様に許容される変動性が増加することが反映されている。
ここで提供される手引きは、さまざまな装置がこのプロファイルに適合する場合の最小の計測誤差を推測している。しかし、より高性能な装置を用いた場合には、計測誤差は有意に減少する可能性がある。
これらの要件は、臨床試験のデータ、理論的解析、シミュレーション、文献のレビュー、専門家の総意を検討した結果、提示されている。しかし、ここに提示された仕様は厳密な研究によって完全に実証されたものではない。臨床現場に導入されることによって、実際の性能のデータが集積され、要件の適切な変更や、プロファイルの詳細の変更がなされる可能性がある。その時には、この項目は削除されるか、再検討される可能性がある。
要件2(結節体積変化)臨床的解釈
要件にあるprecisionの値は、95%の信頼性をもって真の変化があった、と判断するのに必要な値である。もし、腫瘍のサイズ変化がこの値を超えた場合には、95%の信頼性で、単なる計測の変動制によるものではなく腫瘍の真のサイズ増加があったと言える。ただし、これは、生物学的に有意な変化であることを示したものではなく、単に計測された変化が真実かどうかの確かさを見ているものである。
実際の適用例を以下に示す。
例1:
ベースラインで524 mm3 (直径10.0mm)と計測された結節がフォローアップで917 mm3(直径12.0mm)と計測された。計測された変化は+393 mm3 もしくは75%の増加[(917-524)/524×100=75%]となる。このベースラインで直径10mmの結節に対して、Table 1の5行目のCVの値(0.14)を適用すると、75% > 39% [75% > 2.77×0.14×100]であるため、95%の信頼性をもって計測された変化が真の変化であると言える。
変化の強さを定量するために真の変化量の95%信頼区間をみてみると、(917-524)±1.96×√([0.14×524]2+[0.11×917]2)= 393 ± 244となり、149 mm3~637 mm3となる。つまり、フォローアップの時点の結節体積はベースラインの時点より、149 mm3~637 mm3だけ大きいといえる。
例2:
ベースラインで180 mm3(直径7.0mm)と計測された結節がフォローアップで 270 mm3(直径8.0mm)と計測された。計測された変化は+90 mm3 もしくは50%の増加[(270-180)/180×100=50%]となる。このベースラインで直径7mmの結節に対して、Table 1の2行目のCVの値(0.23 )を適用すると、50% < 80% [50% < 2.77×0.23×100]であるため、信頼性をもって計測された変化が真の変化であるとは言えない。
プロファイルの通りにアクティビティが行われれば、それぞれのサイズの結節において、計測された変化は95%の信頼性をもって、正確であると言える。結節のサイズが異なる場合に異なる変動係数を用いるのは、計測装置の分解能の限界によって変動が増加し、このプロファイルの仕様に許容される変動性が増加することが反映されている。
これらの要件は、各サイズの結節に対する再現性係数(RC = 1.96 ×√2 × wCV)を表している。この要件は臨床試験のデータ、理論的解析、シミュレーション、文献のレビュー、専門家の総意を検討した結果、提示されている。しかし、ここに提示された仕様は厳密な研究によって完全に実証されたものではない。臨床現場に導入されることによって、実際の性能のデータが集積され、要件の適切な変更や、プロファイルの詳細の変更がなされる可能性がある。その時には、この項目は削除されるか、再検討される可能性がある。
要件2では2つの時点の計測において、同じアクター(装置、放射線科医、画像解析ツールなど)を想定している。もしアクターが一部でも異なった場合には、計測の性能は減少すると考えられる。
下記のアドレスに、Web上で利用可能な上記の公式のオンライン計算機が公開されている。
http://www.accumetra.com/NoduleCalculator.html.
3. プロファイルアクティビティ
このプロファイルはアクターがアクティビティを実施するという形式で記述されている。装置、ソフトウェア、スタッフ、実施施設などが下表に挙げられるアクターとして、プロファイルへの適合性を求められる。
アクターが各Sectionのすべての必要条件を満たすことで挙げられているアクティビティを実施することができる。
Table 3-1: アクターと求められるアクティビティ
| アクター | アクティビティ | Section |
|---|---|---|
| 撮影装置 | 製品検証 | 3.1 |
| 画像解析ツール | 製品検証 | 3.1 |
| 放射線技師 | スタッフの質的評価 | 3.2 |
| プロトコールデザイン | 3.4 | |
| 被験者の取り扱い | 3.6 | |
| 画像データの取得 | 3.7 | |
| 画像再構成 | 3.8 | |
| 画質評価 | 3.9 | |
| 放射線科医 | スタッフの質的評価 | 3.2 |
| プロトコールデザイン | 3.4 | |
| 被験者の選択 | 3.5 | |
| 被験者の取り扱い | 3.6 | |
| 物理士 | 装置の質的評価 | 3.3 |
| プロトコールデザイン | 3.4 | |
| 画像データの取得 | 3.7 | |
| 臨床医 | 被験者の選択 | 3.5 |
| 画像解析者 | スタッフの質的評価 | 3.2 |
| 画像データの取得 | 3.7 | |
| 画質評価 | 3.9 | |
| 画像解析 | 3.10 |
アクターの責任者である組織の正式な適合要件は、QIBA適合性ステートメントという形式でまとめられる。
QIBA適合性ステートメントを公開する製品開発者は、その製品がどのように適合性を達成しているかを記述した「Model-specificなパラメーター」を提供する必要がある。
Section3, 4にまとめられている仕様と評価手順は、このプロファイルの要件を満たすデータが得られるような通常のCTの臨床手順を反映している。CT装置や解析ソフトウェアについては、計測誤差を減少させるためのより厳密な評価手順が求められる可能性がある。変動の技術的原因についての研究が継続され、このプロファイルの仕様の修正によりaccuracyやprecisionが改善されることで、このプロファイルの将来のバージョンでは定量的画像解析についての、より改善した要件とより特定の評価手順を含むことが予想される。
このプロファイルの必要条件はstandard of care (標準的なケア)を体系化するものではなく、要件を達するためだけにある手引きである。このプロファイルの必要条件をみたすことができなかった場合はプロトコールの逸脱となる。ただし、そのような逸脱は、理にかなっていて、避けられないことがある。そして放射線科医や臨床医は、患者や被験者の最大の利益のために必要な場合には、逸脱を許容することが期待される。研究のスポンサーなどが逸脱をどのように扱うかは彼らの裁量の範疇である。
装置や画像解析ツールのアクターについては、要件への適合性の評価をするのは主に製品開発者であるが、適合性のチェックを必要とするのは実施施設であることがある。例えば、古いモデルの装置を使っている施設が臨床試験に参加するために適合性のステートメントを必要とするが、製品開発者はその古いモデルの販売促進をもはや行っていない、ということが起こりうる。
物理士は関連する仕様の装置性能を管理する責任のある人間であることが望ましい。これはその施設の職員の物理士である場合もあるし、請負業者や装置ベンダーのサービス業者の管理者である場合もある。
このプロファイルに規定されているアクターの流れをFigure 1に示す。
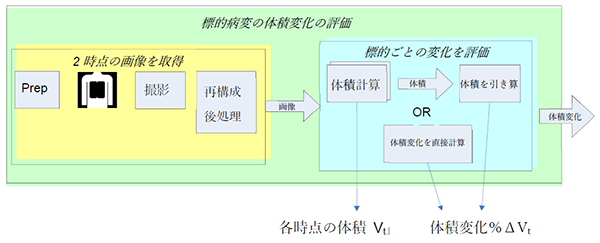
Figure 1: CT腫瘍体積計測 - アクティビティの流れ
腫瘍体積変化の計測方法は、多段階の手順となっている。被験者が撮影の準備をされ、画像のローデータが取得され、画像再構成・後処理が行われる。このような画像が1時点もしくは複数の時点で得られる。画像解析によって2つの時点の変化は、各標的病変の結節について各時点の体積の差分を計算することで得られる。パーセンテージで表示する場合には、体積の変化は2つの時点の体積の差を、初回の体積で割ったもので示す。パーセンテージの表示の場合は非対称性が生じてしまう。つまり、体積の計測値が50cm3 と100 cm3 であった場合、どちらが先かにより、100%の増加もしくは50%の減少という風に表現されることになってしまう。しかし、分母に2つの時点の平均を使用するよりは、こちらの方が臨床現場では馴染みがあると考えられる。
このように得られた変化率は、様々な基準によって解釈されるが、そのような解釈基準についてはこの文書の範疇を超えるものである。結節の検出と分類についてもこの文書の範疇を超えるものである。
プロファイルの必要条件をみたして要件を達成する性能を持つことを確認するには大きな労力が必要となるが、このプロファイルには変革を妨げる意図はない。
上記のようなパイプラインによってリファレンスとなるモデルが得られる。別の手法によるアルゴリズムで、リファレンスモデルと同じ結果を達成できるようなものは容認される。例としては、体積のそのものを計測するのではなく、2つの画像セットでの変化を直接計測するような方法が挙げられる。アルゴリズムの開発者は、適切なQIBA委員会と協働して、性能を示すのに必要な評価を行うことが推奨される。
ここに挙げられている必要条件は、能力のベースラインのレベルを規定するものであって、より高い性能のものは容認されるし奨励される。このプロファイルは、装置の提供者が必要条件をどのようにみたすということを制限するものではない。
3.1 製品の検証
このアクティビティは製品としてのアクター(装置や画像解析ツール)を、このプロファイルに基づいて使用するにあたっての、工場などでの事前評価に関するものである。このプロファイルの要件を信頼性高く満たすために必要な検証や制度の評価を含め検証や性能評価を含んでいる。
3.1.1 考察
特定のプロトコールにおける性能評価はこのsectionには含まれていない。それについてはSection3.4.2に記述されている。
検出器の列数はスキャン時間、Z軸方向の分解能、放射線量などに影響する。Z軸方向の十分な分解能が得られるピッチで、1回の息止めで肺全体を撮影してモーションアーチファクトを最小にできるようなスキャン時間を達成するために、最小で16列が必要である。16列より少ない列数のCTでは、一回の息止めで肺全体を撮影できるような高いピッチにした場合に、一部の患者でZ軸方向の分解能が不十分になる可能性がある(26)。16列のCTを使って、このプロファイルの要件を満たす正確な結節体積計測ができることを示した検討がいくつか報告されている。
3.1.2 仕様
| パラメーター | アクター | 必要条件 |
|---|---|---|
| 撮影プロトコール | 撮影装置 | Section3.4.2プロトコールデザイン仕様書に示される全てのパラメーターにあわせたプロトコールを保存し、撮影ができること。 |
| 撮影装置 | Section3.4.2プロトコールデザイン仕様書に適合するプロトコールを準備できること。 | |
| 撮影プロトコールのバリエーション | 撮影装置 | Designs of Experiments(DOE)アプローチを使って、様々な状況でプロトコールの検証ができること。 DOEアプローチについて、詳しくはSection4.2装置ベンダーの手順を参照のこと。 |
| 検出器の列数 | 撮影装置 | 16列よりも多いこと。 |
| Image header | 撮影装置 | Section3.4.2プロトコールデザイン仕様書に挙げられているDICOMタグの値を、DICOMのImage headerに記録ができること。 |
| Reading Paradigm (画像読影時) |
画像解析ツール | 比較のために二つの時点の画像を並べて表示できること。 |
| 変化計算 | 画像解析ツール | 二つの時点の体積の差を、最初の時点の体積の割合で計算できること。単位はmm3で表示できること。 |
| 科学的検証 | 画像解析ツール | 線形性、変動係数、ゼロバイアスといった適切な科学的検証ができること。 |
3.2 スタッフの質的評価
このアクティビティは、人間のアクター(放射線科医、物理士、放射線技師)がこのプロファイルに参加する前に、その能力を評価するものである。
3.2.1考察
この必要条件は、他のQIBAプロファイルの必要条件と同様に、このプロファイルの要件を達成することだけに焦点をあてたものである。参加するアクターの医学的、職業的能力の評価はこのプロファイルの範疇外にある。
臨床の場では、読影・画像の解釈を行う放射線科医が画像解析者となることが多い。しかし一部の実施施設や臨床研究の場では、放射線科医でないものが画像解析をすることもある。画像解析者としてのトレーニングは、体積計測を行うCTの世代や構成要素、画像再構成や後処理の原理、定量評価に影響する技術的要因、関連するCT画像解剖、結節の定義、アーチファクトなどのトピックを含み、セッティングや計測のために必要なレベルに達していなければならない。
3.2.2 仕様
| パラメーター | アクター | 仕様 |
|---|---|---|
| ACRの認定 | 放射線科医 | American College of Radiology(ACR)のCT認定プログラムを達成していること。 American Board of Radiologyまたは同等の認定組織の資格認定、認定組織が要求するCTの読影件数・見落とし件数、認定組織が要求する継続した教育をうけること、などを含む。 以下のアドレスを参照のこと。 http://www.acraccreditation.org/modalities/ct |
| 放射線技師 | ACRのCT認定プログラムを達成していること。 American Registry of Radiologic Technologistsまたは同等の認定組織の資格認定、CT撮影の訓練と経験数、認定組織の要求する継続した教育をうけること、などを含む。 以下のアドレスを参照のこと。 http://www.acraccreditation.org/modalities/ct |
|
| 解析者のトレーニング | 画像解析者 | 放射線科医による肺癌検診の肺結節のCT体積評価の文書化された訓練を受け、このプロファイルの必要条件を満たすこと (もし画像解析者がこのプロファイルに適合する放射線科医である場合は、追加のトレーニングは必要ではない)。 |
3.3 装置の性能評価
このアクティビティは、特定の被験者に直接かかわらない画像装置の性能評価に関わるものである。このプロファイルの要件を信頼性高く満たすために必要な、キャリブレーション、ファントム画像、性能評価・検証といったことが含まれている。
3.3.1考察
このアクティビティは装置が正しく、調整・キャリブレーションされ、機能していることを確認するものである特定のプロトコールのための性能評価は、ここには記載されていない。それはSection3.4に記載されている。
このプロファイルの必要条件を満たすには、アメリカ合衆国の連邦規制(21 CFR 1020.33)もしくは合衆国外の類似の規制を遵守すること、American College of Radiology(ACR)のCT認定プログラムのCT装置の評価手順(http://www.acraccreditation.org/modalities/ct)をみたすこと、装置メーカーによるクオリティコントロールの手順をクリアしていることが必要となる。これらの評価手順は、医学物理士による少なくとも年に1回の技術的な性能評価が含まれる。評価されるパラメーターは、空間分解能、Section thickness、テーブル移動の正確性、線量計測といった、小結節の定量的体積計測に重要な項目を含んでいる。
日常的なクオリティコントロールとして、水のCT値と標準偏差、およびアーチファクトの評価をする必要がある。また、サービスエンジニアによる定期的な予防的メンテナンスも必要である。
これらの仕様は、このプロファイルの要件の作成に使われたデータを提供した実施施設や臨床研究の状況を反映している。データは様々なCT装置のモデルから得られており、このプロファイルの要件の信頼限界のサイズに反映されている。現在進行中の研究で、肺癌検診での性能を決定付ける重要な技術的パラメーターが検討されており、このプロファイルのものより、より狭い信頼限界の要件を満たすような指標が確立されようとしている。それにより、肺癌検診におけるより特異的なCT体積計測の方法や評価手順は、このプロファイルの将来のバージョンで記載されていくことになる。
3.3.2 仕様
| パラメーター | アクター | 必要条件 |
|---|---|---|
| クオリティコントロール | 物理士 | 日常臨床で一般的に必要となるクオリティコントロールの手順ができること。 |
| クオリティコントロール | 物理士 | メーカーやACR認定プログラムによる特定の定期的なクオリティコントロールや管理手順を行えること。 参考:http://www.acraccreditation.org/modalities/ct |
| メンテナンス | 物理士 | CTメーカーによって推奨されるサービスエンジニアによる、適切な定期的・予防的なメンテナンスを確認すること。 |
3.4 プロトコールデザイン
このアクティビティは、このプロファイルで用いられる撮影と画像再構成のプロトコールに関するものである。プロファイルの要件を満たすために必要な撮影パラメーターや画像再構成のパラメーターの制限を含んでいる。
3.4.1 考察
このプロファイルでは、撮影する施設でプロトコールデザインを行うことを想定しているが、他の施設で構築されたプロトコールを使用することもできる。
仕様の決定においては、特定の技術というよりは、データセットにつながる特性に可能な限り焦点を当てた。これは、体格の大きな患者に対して撮影mAsや画像再構成のFOVを増加させる、など患者の体格に合わせた合理的な調整や製品開発に対して可能な限り柔軟性を持たせるためである。装置ベンダーによって提供される技術的パラメーターセットは、さらなる手引きを必要とする場合に有用である可能性がある。
肺癌検診においては、放射線量低減の必要性が撮影パラメーターに強く影響する。放射線量はCT Dose Index (CTDIvol)によって示される。CTDIvolは肺結節を検出するのに必要な画質を維持する最低量である必要がある。低線量撮影によるCT肺結節体積計測の変動性は、通常線量撮影と同等であるとされている(14, 17, 18, 27, 28)。一般的な手引きとしては、CTDIvol ≦ 3mGy 程度で、International Commission on Radiation Protection (ICRP)が定める標準体格(身長170㎝、体重70kg)の被験者に対して十分な画質を提供できる。体格の小さな被験者ではCTDIvolを小さく、体格の大きな被験者ではCTDIvolを大きくする必要がある。ただし、同じ患者では、常に同じ撮影条件である必要がある。CTDIvolは管電圧(kV)、管電流(mA)、ローテーションタイム、ピッチといった様々なパラメーターによって決まる。これらのパラメーターのセッティングは達成すべきCTDIvolレベルによって変動することになる。ピッチは1回の息止めでZ軸方向の十分な空間分解能が得られる値が選択される。
Automatic Exposure Controlはスキャン中に肺全体で一定のノイズレベルが達成されるように管電流を調整するものである。Automatic Exposure Controlの使用はプロファイルの要件に与える影響は小さく、使用を考慮してもよいが、他のパラメーターと同様にベースラインと一致していなければならない。不必要な放射線被曝量を低減させることができるが、一部の被験者では、目標とするノイズレベル、被験者の体格や解剖的要因、ベンダーに採用された制御方法などによって放射線量が増加する原因にもなる。これらの要因は、個別の被験者でAutomatic Exposure Controlを使用するかどうか決定するのに留意しておかなければならない。
ローテーションタイムは他のパラメーターに合わせて決定される。一般的には0.5秒以下とされることが多い。
Nominal Tomographic Section ThicknessはInternational Electrotechnical Commission (IEC)でよく使われる用語で、シングルコリメーション幅とも呼ばれる。その装置のモデルの検出器の幾何学的配置を考慮して決定される。Z軸方向の空間分解能に影響を与え、画像再構成時のスライス厚の選択肢にも影響を与える。より薄いSectionにすることで、画像再構成時のボクセルサイズが小さくなり、パーシャルボリュームエフェクトを減少させる。また、分解能の向上によってより正確な計測が可能になる。
画像再構成関数は、エッジ強調(Edge Enhancement)がなく、高い分解能を提供できるmedium smoothもしくはmedium sharpな関数が推奨される。
X線CTはイオン化放射線を利用するため、放射線被曝のリスクがあるが、放射線量が少ないと画質は劣化してしまう。ヘルスケアの専門家が被験者ごとに放射線量のリスクと、画質のバランスをとる必要がある。これらのトレードオフを解決することは、このプロファイルの範疇外である。
3.4.2 仕様
プロトコールのパラメーター決定について、装置ベンダーの推奨する設定を使ってもよいが、放射線科医が責任を負う。また、放射線科医がプロトコールの検証が行われていることを確認する責任がある。確認自体は物理士もしくは放射線技師が行ってもよい。物理士は、施設内の医学物理士でもよいし、請負業者やベンダーのサービスエンジニアなどのスタッフでもよい。
| パラメーター | アクター | 仕様 | DICOMタグ |
|---|---|---|---|
| 撮影プロトコール | 放射線科医、 放射線技師 |
このTableの仕様を満たすプロトコールを準備すること。放射線技師はこのプロファイルの必要条件にある訓練を受けること。 | |
| Nominal Tomographic Section Thickness | 放射線科医、 放射線技師 |
1.25mm以下であること。 | Single Collimation Width (0018,9306) |
| 再構成プロトコール | 放射線科医、 放射線技師 |
このTableの仕様を満たすプロトコールを準備すること。放射線技師はこのプロファイルの必要条件にある訓練を受けること。 | |
| 再構成スライス厚 | 放射線科医、 放射線技師 |
1.25mm以下であること。 | Slice Thickness (0018,0050) |
| 画像再構成間隔 | 放射線科医、 放射線技師 |
再構成画像スライス厚以下であること (ギャップがないこと、オーバーラップはあってもよい)。 | Spacing Between Slices (0018,0088) |
| 分解能(Resolution) | 放射線科医、 放射線技師、 物理士 |
以下の条件を満たすこと ・3D PSF sigma ellipsoid volumeが1.5mm3以下であること。 ・Z PSF sigmaが面内PSF sigmaの2倍以下であること。 Section4.1技術的な評価方法を参照のこと。 |
|
| エッジ強調(Edge Enhancement) | 放射線科医、 放射線技師、 物理士 |
5%を超えるエッジ強調(Edge Enhancement)がみられないこと。 Section4.1技術的な評価方法を参照のこと |
|
| HUバイアス (HU Bias) |
放射線科医、 放射線技師、 物理士 |
空気とアクリルで、HUバイアスが35HU以下であること。 Section4.1技術的な評価方法を参照のこと |
|
| ボクセルノイズ (Voxel Noise) |
放射線科医、 放射線技師、 物理士 | 空気とアクリル素材の均一なファントムで、標準偏差が50HU以下であること。 Section4.1技術的な評価方法を参照のこと |
|
| 空間歪み(Spatial Warping) | 放射線科医、 放射線技師、 物理士 |
3次元画像撮影で、空間歪み(Spatial warping)がRoot Mean Square Error (RMSE) <0.3mmを満たすこと。 Section4.1技術的な評価方法を参照のこと |
3.5 被験者の選択
このアクティビティは、このプロファイルの要件を満たすのに必要な、適切な被験者の選択に関する基準と手順を記述している
3.5.1 考察
呼吸器症状がある場合、急性または亜急性の肺の異常が示唆され、肺結節の体積計測の障害となったり、値が変化してしまったりする可能性がある。また、撮影時の息止めの障害にもなる。それゆえ、被験者はベースラインにおいて心臓や肺に関して無症状でなければならない。結節のフォローアップにおいて、時期を逸してしまう、または新規の症状の精査をする必要があるといったことのために撮影をせざるを得ない場合は、これらの臨床状態によりこのプロファイルの要件を満たさなくなる可能性がある。
肺線維症のような慢性的な異常も結節体積計測の正確性に影響する可能性があるため、このプロファイルの要件を満たさない可能性がある。
気管支鏡、胸部手術、放射線治療といった診断的もしくは治療的医療処置は結節周囲の肺の濃度を上昇させてしまい、このプロファイルの要件を満たさなくなる可能性がある。
肺とは無関係の消化管造影や腹部CTでの経口造影剤が食道、胃、腸管などに残存している場合、結節の定量評価に影響するアーチファクトを生じる可能性がある。そのようなアーチファクトが計測対象の肺結節と同じ面内に存在する場合、このプロファイルの要件を満たさない可能性がある。
3.5.2 仕様
| パラメーター | アクター | 必要条件 |
|---|---|---|
| 医療処置 | 臨床医 | 肺結節とその周囲の肺組織の濃度を変えてしまうような医療処置については、撮影を事前に行うか、処置から撮影まで適切な間隔をあけること。 |
| 放射線科医 | ||
| 呼吸器症状 | 臨床医 | 呼吸器症状がある場合には、可逆的なCTの異常が改善するまで撮影を遅らせること。 |
| 放射線科医 |
3.6 被験者の取り扱い
このアクティビティは各時点における被験者の取扱いに関するものである。
3.6.1 考察
このプロファイルでは「被験者(subject)」としているが、必要条件と推奨事項は一般に患者に適用されるものであって、被験者はしばしば患者でもある。
この被験者の取扱いの手引きは、周囲の病変疾患やアーチファクトによって結節が不明瞭化してしまい、計測値が変化してしまう可能性を減少させ、複数回の撮影における画質の一貫性を保つ意図がある。
経静脈的造影剤は肺癌検診には用いられない(29)。肺結節と周囲の肺実質のコントラストはもともと最も高いため、肺結節の検出や評価に造影剤は不要である。造影剤はコスト増加、腎毒性、副作用のリスクなどがあり、結節体積計測にも影響を与える(30, 31)。もしも結節の質的診断や肺門のリンパ節の評価などのために臨床的に造影剤が必要になった場合には、このプロファイルの要件を満たさなくなる。
ローカライザー(スカウト)画像の取得後に、放射線技師は体外の金属製品などアーチファクトの原因となるものがないか画像を評価し、被験者から取り外さなければならない。そのようなアーチファクトは肺結節の濃度を変えてしまう可能性がある。ペースメーカーや脊椎の器具のような体内の金属製のデバイスもアーチファクトを生じる可能性がある。
放射線量を減少させるために使われるビスマス製のブレストシールドも画像のノイズを増加させる。これによるアーチファクトが肺結節の体積計測に与える影響は不明であるが、肺癌検診での低線量CTにおいてはその影響が大きくなる可能性がある。ブレストシールドの画質に対する影響は、シールドの種類やポジショニングによって変化しうる。American Association of Physicists in Medicineでは現在はブレストシールドの使用を推奨しておらず、他の線量低減の方法を推奨している(https://www.aapm.org/publicgeneral/BismuthShielding.pdf)。このようにブレストシールドの使用はこのプロファイルの要件に合致せず、肺癌検診において推奨されない。前胸部の線量を低減させるようなorgan dose modulationは、比較されるすべての撮影に適用されるのであれば、使用可能である。
被験者のポジショニングに一貫性をもたせることは、X線ビームハードニングの変動を抑え、ガントリー内の結節の位置や方向の変動を抑えるのに重要である。ガントリーの中心にポジショニングできていない場合には、放射線量もノイズも増加する(32, 33)。(乳腺を除いて)胸部をガントリーの中心にポジショニングすることは、肺の全体的なCT値の一貫性を改善させ、スキャンごとの線量調整アルゴリズムの挙動の変動を減少させる。被験者には楽な姿勢を取ってもらい、モーションアーチファクトの可能性を抑え、うまく息止めが出来るようにする必要がある。
通常臨床と同様に、被験者は仰臥位で両腕を挙上させる必要がある。胸骨はテーブルの中央線上に位置していなければならない。中腋窩線がガントリーの最も広い部分になるようにテーブルの高さとセンタリングが調整されなければならない。膝や頭の下にポジショニング用の枕を使用することは、脊椎や肩がより良い姿勢になり被験者が楽な姿勢でいられるようにするために必要なことがある。各実施施設の習慣や患者の身体的状態・制約によって、患者のポジショニングは影響を受ける。撮影ごとの一貫性を保つアプローチが重要である。
モーションアーチファクトを低減させ、セグメンテーションを改善させるために、最大吸気での息止めで撮影を行う必要がある。吸気レベルは肺結節の体積計測に影響を与える可能性があるため(21, 34, 35)、すべての撮影で、一貫性・再現性の高い最大吸気で撮影する努力が必要である。患者が我慢可能なようにライブ音声での息止め指示が強く推奨される。しかし、各現場の判断により、録音した息止め指示でも問題がないこともある。胸壁や腹部の動きを注意深く観察することによって、息止めがうまくできているかどうか確認されなければならない。撮影は、最大吸気に達し、全ての動きが止まっていることが確認されるまで始めてはならない。
撮影を行う前に、息止めの練習をすることが強く推奨される。これによって、被験者は息止めに慣れることができ、放射線技師も被験者の呼吸リズムに慣れ、被験者が難しく感じる部分に対処しやすくなる。
息止め指示の例を以下に示す:
- 「息を吸ってください」(前胸壁が上がるのを見る)
- 「息を吐いてください」(前胸壁が下がるのを見る)
- 「では、できるだけ大きく息を吸って、吸って、吸って、吸って…」
- (胸部と腹部の動きが止まったら)「息を止めてください」
- 声帯が閉じてから横隔膜が弛緩するまでの時間を考慮しつつ、胸部と腹部が止まっている間に撮影を開始する。
- (撮影が終わったら)「楽にしてください」
| パラメーター | アクター | 必要条件 |
|---|---|---|
| 経静脈的造影剤 | 解析者 | 肺癌検診やフォローアップにおける肺結節の体積計測においては、経静脈的造影剤が使用された画像は使用しない。 |
| 放射線科医 | ||
| アーチファクト源 | 放射線技師 | 再構成された画像の劣化がないように、ブレストシールド、金属を含んだ服、心電図のリードなどのアーチファクトの原因となるような金属製品は、取り除くか、位置を変えること。 |
| 被験者のポジショニング | 放射線技師 | ベースライン時と同じようにポジショニングすること。 |
| テーブルの高さとセンタリング | 放射線技師 | 中腋窩線がガントリーのアイソセンターを通過するように、 テーブルの高さを調整すること。ベースラインと同様にすること。 |
| 息止め | 放射線技師 | 被験者が適切な息止めできるように指示する。深吸気になってから、横隔膜が弛緩するまでのタイムラグを考慮して、撮影を開始する。ベースラインと同程度の吸気レベルであることを確認する。 |
3.7 画像データ取得
このアクティビティは、各時点の画像データ取得に関するものである。このプロファイルの要件を満たすために必要なデータ取得の詳細を記述している。
3.7.1 考察
このプロファイルに記載されている仕様に合致する装置は、肺結節体積計測のCT撮影に使用することができる。しかし、変動を減らすためには、各被験者についてすべての撮影は理想的には同じプラットフォーム(メーカー、モデル、バージョンなど)で撮影されるべきである。
「肺結節体積計測のために準備され、検証されたプロトコールを選択する」という必要条件については、放射線技師が被験者を撮影する前に毎回ファントムを撮影することを要求するものではない。Section3.4.2で記載されているが、使用するプロトコールがその実施施設で検証されることが要求されている。
多くの撮影パラメーターは直接的・間接的に結節の検出・セグメンテーション・計測に影響を与える。これらの変動の影響を小さくするために、多くの撮影パラメーターは、可能な限りベースラインと一貫している必要がある。
ベースラインとの一貫性については、ベースラインでの設定が記録され、経過観察の撮影時に参照可能でなければならない。装置が前回もしくはベースラインの画像を保存し、撮影パラメーターを抜き出すような機能も考えられるが、Image headerに記載する以上のことは必須ではなく、そのような運用性に関してはここでは規定しない。多施設が関わる場合には、データの管理や転送について、参加する施設の能力を超える可能性がある。主となる施設は撮影方法のマニュアルを準備しておく必要がある。
Image headerは、ベースラインとの一貫性を保つために重要なパラメーターを記録している。
パラメーターの一貫性の目標は、性能の一貫性を達成することである。同じ装置を用いた場合には、パラメーターの一貫性とは同じ値を用いることである。もしも異なるモデルを使った場合には、パラメーターの一貫性とは性能の一貫性を達成するために解釈が必要になる可能性がある。なぜなら異なるモデルでは、同じ値が異なる挙動を示す可能性があるからである。Section3.4プロトコールデザインを参照のこと。
解剖学的撮影範囲について、検診目的ではベースラインの撮影は肺尖部から肺底部まで肺全体が撮影範囲に含まれてなければならない。しかし、放射線量をなるべく少なくするために必要最小限の撮影範囲である必要がある。結節の計測のためには、撮影は結節の上下5~10mmの肺野を含む必要がある。
ローカライザー(スカウト)は解剖学的ランドマークを同定するために必要な最小の管電圧と管電流で、最小限の範囲で撮影されなければならない。また、ポジショニング時に見逃された体外の金属製品などを発見するためにも使用される。
Section3.4.1に記載されているように、CT Dose Index (CTDIvol) 3 mGy以下で標準的な体格(身長170㎝、体重70kg)の人では十分な画質が得られる。体格の小さな被験者では小さく、体格の大きな患者では大きくする必要がある。ただし、同じ患者では全ての撮影で同じ設定を使用しなければならない。管電圧(kV)、管電流(mA)、ローテーションタイム、ピッチは、必要なCTDIvolのレベルに応じて調整されなければならない。
1管球のX線CTではピッチは2.0を、2管球の場合にはそれに相当する値を超えないことが推奨される。
3.7.2 仕様
撮影装置は、下記のTableに記載されたすべてのパラメーターで撮影が可能であること。放射線技師は、下記のTableの必要条件を満たす設定で撮影を行うこと。
| パラメーター | アクター | 必要条件 | DICOM Tag |
|---|---|---|---|
| 撮影プロトコール | 放射線技師/ 放射線科医 |
このプロファイルのために準備され、検証されたプロトコールを選択すること。 (3.4.2プロトコールデザインを参照のこと)。 |
|
| スキャン中 | 放射線技師 | 1回の息止めで撮影すること。 | |
| 一貫性 | 放射線技師 | フォローアップの撮影では同じCT 装置・同じ撮影プロトコールを使用すること。 |
3.8. 画像再構成
このアクティビティは、各時点の画像再構成に関するものである。このプロファイルの要件を満たすのに必要な画像の作成に関する基準や手順が記載されている。
3.8.1 考察
多くの画像再構成パラメーターが結節の検出・セグメンテーション・計測に影響する。これによる変動を抑えるため、フォローアップの撮影ではベースラインと可能な限り同じパラメーターを使う必要がある。
再構成Field of View (FOV)はマトリックスサイズとともに再構成された画像のピクセルサイズに影響する。マトリックスサイズは512×512が最もよく使われる。ピクセルサイズは、X-Y面内方向のボクセルサイズに直接的に影響する。ボクセルサイズは小さい方が、部分容積効果が減少する。部分容積効果は結節の境界を不明瞭化させ、計測の正確性を損なわせる。各方向のピクセルサイズは各方向の空間分解能とは同一ではない。空間分解能はSection厚や再構成関数といった他の要素も影響する。小さいFOVを使ったターゲット再構成は通常の肺全体を含むFOVと比べて部分容積効果を減少させるが、体積計測に与える効果は限定的である。再構成FOVを両肺の最大径を含むよう設定し、ベースラインと一貫性を持たせることが、このプロファイルの要件を満たすのに十分な条件である。
再構成スライス厚はCT検診で発見されフォローされている最も小さな結節のサイズよりも小さくなければならない(11-13, 36)。
再構成間隔はcontiguous(隣接)もしくはオーバーラップしている、つまり再構成間隔が再構成スライス厚よりも小さい必要がある。contiguousでもオーバーラップでもこのプロファイルの要件を満たすが、50%のオーバーラップの方がより正確な計測が可能になる(37)。オーバーラップを使用することで画像枚数増加、スループット低下、読影時間の延長、保存容量増加などが生じるが、放射線被曝量には影響がない。ギャップのできてしまう再構成間隔は容認されない。なぜなら、結節の一部が切り捨てられ、結節の境界の同定が難しくなり体積計測の正確性に悪影響を与えるからである。
再構成アルゴリズムの種類は最もよく使われるのはfiltered back projection(FBP)である。近年では逐次近似法が導入され、ノイズの低減と放射線量の低減の両立が可能となっている(38)。CTでの体積計測においては、少なくともFBPと同等の結果が出せるという報告がされている(16-18, 28 , 39)。どちらのアルゴリズムもこのプロファイルでは使用可能とする。
再構成関数は、結節の境界の明瞭さなど再構成とされた画像での結節の見え方やテクスチャーに影響を与える。一般的には、softでsmoothな関数はノイズを低減させるが、分解能が犠牲になる。一方で、sharpで高周波な関数は分解能を改善させるが、ノイズが増加してしまう。関数の影響はセグメンテーションソフトウェアによって異なる。理論的には、エッジ強調(Edge Enhancement)のない最も分解能が高いものを使用するべきであるが、一般的には、medium smoothもしくはmedium sharpのものが使われる。関数がsmoothになると結節体積の過小評価が問題になるが、関数がsharpになると画像ノイズとセグメンテーションエラーが問題となる。ベースラインとフォローアップで同じ再構成関数を使うことが、このプロファイルの要件では特に重要である。
3.8.2 仕様
| パラメーター | アクター | 仕様 | DICOM Tag |
|---|---|---|---|
| 再構成プロトコール | 放射線技師 | このプロファイルのために準備され、検証されたプロトコールを選択すること。 (3.4.2プロトコールデザインを参照のこと)。 |
|
| 再構成 Field of View |
放射線技師 | 胸部もしくは腹部全体がカバーされ、かつ、大きすぎないこと。ベースラインと一貫性を持たせること。 | Reconstruction Field of View (0018,9317) |
| 再構成スライス厚 | 放射線技師 | 1.25 mm以下であること。ベースラインと同じであること。 | Slice Thickness (0018,0050) |
| 再構成間隔 | 放射線技師 | スライス厚以下であること。ギャップはあってはならない。オーバーラップはあってもよい。ベースラインとの一貫性を持たせること。 | Spacing Between Slices (0018,0088) |
| 再構成関数 | 放射線技師 | ベースラインと一貫性のある関数と設定を用いること (可能なら同一の関数・パラメーターを使用すること。できない場合はベースラインともっとも近いものを使用すること)。 |
Convolution Kernel (0018,1210), Convolution Kernel Group (0018,9316) |
3.9 画質評価
このアクティビティは、解析に先立って再構成された画像を評価するものである。このプロファイルの要件を満たすために必要な画像の基準が含まれている。
3.9.1 考察
このアクティビティでは、画像の生成から解析をするまでの間に、画像の各特性がプロファイルに適合しているか確認するものである。ここに挙げられているものはQIBAプロファイルの要件を達成するために選んだものである。他の評価項目についても、より良い画質を得るために検討されることが期待される。
多数の項目が画質に影響を与え、結節体積計測の誤差を生じる。モーションアーチファクトとデンスオブジェクトアーチファクトは、サイズ・形状・結節の境界を変化させてしまう。一部の胸部疾患も結節周囲の肺の濃度を変化させてしまい、その結節の真の境界を同定することが難しくなる。肺血管、胸壁、縦隔、横隔膜といった解剖学的構造と結節が接触していると、結節の境界の視認性が悪くなり、真の境界がわかりにくくなってしまう。全体的な結節の計測性を損ない、結節検出の感度が低下してしまうような画質の劣化の原因がある場合にはこのプロファイルの要件は適用されない。
3.9.2 仕様
| パラメーター | アクター | 必要条件 |
|---|---|---|
| モーションアーチファクト | 放射線技師 | モーションアーチファクトがないことを確認すること。 |
| 画像解析者 | ||
| デンスオブジェクトアーチファクト | 放射線技師 | 濃度の高い物体や解剖学的構造によるアーチファクトがないことを確認すること。 |
| 画像解析者 | ||
| 胸部疾患 | 画像解析者 | 結節の計測性に影響を与えるような胸部疾患がないことを確認すること。 |
| 結節の境界の視認性 | 画像解析者 | 同程度の濃度の他の構造と接触しておらず、十分な距離があることを確認すること。結節結節の表面の1/3以上の領域が同程度の濃度の構造と接触している場合に有意な接触とする。 |
| 結節のサイズ | 画像解析者 | 面内の最大径が、6~10 mmであること。 (球形の腫瘍であれば、約113mm3 ~ 905 mm3 となる) |
| 全体的な結節の計測性 | 画像解析者 | 計測の信頼性を損なうような特性をもつ結節や画像を除外すること。 |
3.10 画像解析
このアクティビティは、被験者の1回もしくは複数回の撮影での体積計測に関わるものである。このプロファイルの要件を満たすために必要な画像からの定量的計測に関する基準や手順を記している。
3.10.1 考察
画像解析は適切で科学的な検証を経た画像解析ツールプログラムを使って行われなければならない。理想的な結節であっても、異なるセグメンテーションアルゴリズムを使ったプログラムを使った場合には、異なる計測結果が得られてしまう。また、プログラムやその一部のバージョンが異なる場合にも、結果が変化する可能性がある。複数時点の計測を行う場合はメーカー、モデル、バージョンなどが同一のプログラムを用いて計測されなければならない。
結節の体積計測は、セグメンテーションと呼ばれる結節の境界の同定がなされ、その境界内の体積を計算することで得られる。典型的には、セグメンテーションはユーザーがシードポイント、カーソルストローク、ROIの設置などによって位置を指定することで、自動的なアルゴリズムによって行われる。得られたセグメンテーションと結節の境界が3次元的に一致するかどうか、視覚的にセグメンテーション評価がなされなければならない。この確認は画像の表示条件に大きく影響される。比較される全ての計測時点で、肺野を見るための同一のウィンドウ幅(WW)・ウィンドウレベル(WL)を使用する必要がある。
マニュアルでの修正無しにセグメンテーションが正確に境界を追跡できた場合は、このプロファイルの要件を最もよく満たすことになる。もしもセグメンテーションが不十分であるという放射線科医の意見があれば、定量的な体積計測は使わず、結節のサイズ変化は、通常の臨床の方法を用いて評価されなければならない。結節の位置や辺縁の特徴はセグメンテーションの質や計測結果に影響を与える。辺縁が肺血管や胸膜に接している結節よりも孤発性で、近くの構造から十分に離れている結節の方が好ましい。また、スピキュラを伴う不整な辺縁の結節よりも、スムーズな辺縁をもつ結節の方が好ましい(40-45)。
2つの時点の体積変化を評価する際、Reading Paradigm(読影時)にはinterobserver variationとintraobserver variationを減少させるために、二つの時点の画像を同時に横に並べて比較する必要がある。セグメンテーションと計測の結果を保存しておくことは、後で確認することができ、時間とコストの節約になるため、有用である。しかし、両方の時点のセグメンテーション結果が十分に正確で、このプロファイルの要件を満たすかどう三次元的に視覚的に評価されなければならない。もし、前回のセグメンテーション結果がわからない場合、もしくは前回のセグメンテーションが今回のセグメンテーションと比べて、十分に正確でない場合、セグメンテーションは比較する時点で再度行われなければならない。このプロファイルで示される仕様を満たすのであれば、個々の時点の体積を計算せずに、体積変化を直接計算する方法を用いることも可能である。方法に関わらず、ベースラインと比較した結節の体積変化を計算し、記録する機能を持つソフトウェアが推奨される。
これらの画像解析の仕様は、特別な訓練を受けたり、特別な能力があったりしない、一般的なユーザーに適用することを想定している。このことを製品開発者は、製品の性能評価や施設への導入にあたって留意しておかなければならない。一部の方法の性能はユーザーの判断や技能に依存するかもしれないが、そのような操作者の経験や質を特定するようなことはこのプロファイルの範疇外である。
3.10.2 仕様
| パラメーター | アクター | 必要条件 |
|---|---|---|
| 画像解析ツール | 画像解析者 | 全ての時点の計測で、メーカー・モデル・バージョンなどが同じ解析ツールを用いること。 |
| 画像解析ツール | 画像解析者 | 画像解析ツールがこの要件が定める計測バイアス、変動係数、計測の線形性を達成しているかどうか確認すること。実施施設での少数のデータセット使って要件をみたすか確認すること。 |
| セグメンテーション評価 | 画像解析者 | 2つの時点での自動でのセグメンテーションが不十分な場合や、セグメンテーションに一貫性がない場合には、その結節を除外すること。 |
| 画像表示条件 | 画像解析者 | 全ての時点での画像は肺野用の適切な表示条件(WW/WL)に設定すること。 |
| 要件計算 | 画像解析者 | 変動係数についてTable 1にない中間的な値については、線形補間を用いること。 |
4. 適合性
このプロファイルに適合するためには、参加するスタッフや装置はTable 3-1で割り当てられたアクティビティをそれぞれ行わなければならない。アクティビティを行うためには、Secton3の各仕様のTableに挙げられている必要条件を満たす必要がある。
Section3に挙げられている必要条件の一部は直接的な観察で適合性を評価することができるが、性能に関する多くの決定的な必要条件ではSection4の評価手順が必要になる。
このSectionは、装置やソフトウェア解析システムの性能評価に用いられる技術的なhyoukahouhou (Section4.1)、装置やソフトウェアが要件を満たすためにベンダーが行わなければならない適合性の手順を示したベンダーの適合性評価手順 (Section4.2)、そして、要件に適合するために実施施設で必要となる実施施設の適合性評価手順 (Section4.3)からなる。
4.1 技術的な評価方法
このプロファイルで、肺結節の体積計測に用いられる装置は、CT装置と解析ソフトウェアの2種類である。CT装置から得られる画像の質と撮影プロトコールの技術的な評価方法についてはSection4.1.1に記載されている。解析ソフトウェアによって得られる計測結果の質の技術的な評価方法についてはSection4.1.2に記載されている。これらの評価方法は、Section4.2ベンダーの適合性評価手順やSection4.3実施施設の適合性評価手順において、プロファイルの要件への適合性を評価するのに用いられる。
今日の臨床の画像については、技術的な基準は、主に定性的な画像用途のために設定されているが、このプロファイルでは定量的な画像の性能評価を行っている。肺結節の小さな変化を信頼性高く計測するためには、厳密な適合性の手順が必要で、難しいタスクとなる。1段階目としては、アクターが自分で関連する仕様の評価手順を行い、仕様の範囲内であるという結果になれば、そのアクターは要件に適合していると判断する。これは「self-attestation(自己証明)」と呼ぶ。2段階目としてはその施設の物理士やアクターによって雇われた請負業者などの第三者が評価を行い、結果を報告するものである。3段階目は利益相反のない中立の客観的な第三者が評価を行い、結果を報告するものである。この中立の第三者による適合性評価手順によって、このプロファイルの要件が求める計測の正確性を満たしていることが証明される。このプロファイルに適合しているかどうか確認する方法の一つとして、スタンダードリファレンスとなるオブジェクトの画像を撮影し、その画像をQIBA適合性評価の自動画質検証にレビューに出すことができる。自動的な解析によって、撮影装置の性能がプロファイルの要件に適合しているかどうかの包括的なレポートが返送される(概ね1時間以内)。
この手順の全体的な目標は、その撮影装置が十分な性能を持ち、特定の撮影パラメーターで、このプロファイルの要件にある統計的な範囲で正確でロバストな画像情報を提供できることを確認することである。
ここに示される適合性評価手順は実施施設や装置ベンダーがこのプロファイルの要件への適合性を示す方法の代表的なものであって、同等の別の評価方法で適合性が示されるかどうか、QIBAに確認することもできる。QIBAによって、その代替となる適合性評価方法がこのプロファイルの目標を満たすことが確認された場合には、その方法も用いることができる。
4.1.1 CTの画質特性
ここに示された方法は、特定の撮影装置と撮影プロトコールで得られ、再構成された画像の特性を評価するものである。その画質特性とは、次の6つの方法で評価される。
- 分解能 (Resolution)は、点状信号源に対するイメージングシステムの推定応答、すなわち、点像分布関数(point spread function、PSF)を用いて評価される。ここでのPSFは、標準偏差sigma [mm:ミリメートル]のガウス分布として特徴付けられ、面内およびZ軸方向の両方で計測される。この値(PSF sigma)の減少は分解能の改善を意味する。
- 分解能アスペクト比 (Resolution Aspect Ratio)は、Z軸方向のPSF sigmaをX軸方向のPSF sigmaで除した比を用いて評価される。
- HUバイアス (HU Bias)は、均質密度(均一濃度)の物質に対して、測定した平均CT値と期待されるCT値との差で評価される。
- ボクセルノイズ (Voxel Noise)は、均質密度(均一濃度)の物質を画像化した場合の、ピクセル集合(HU値)の標準偏差で評価される。
- エッジ強調 (Edge Enhancement)は、周りを空気で囲われた理想的な円柱状信号の外側の縁部分において、期待されるHU値より高くなる部分(コントラスト)の最大パーセント増加量で評価される。
- 空間歪み (Spatial Warping)は、歪みが無い理想的な円柱状のリファレンスオブジェクト(基準物体)表面と中空円柱部分の外表面との平均二乗誤差で評価される。

Figure 1: QIBA CT肺結節ファントムの透過図
評価者は、平均的な体格の患者用の撮影設定を用いて、QIBA承認のCT定量リファレンスオブジェクトの撮影を行う。Figure1に「QIBA肺結節ファントム」の全体像を示す。このファントムは、ベース素材であるEVAフォーム(3ポンド:約1.36kg)の中に、3つの画質評価モジュールが埋め込まれており、それらはCT装置のアイソセンターから、およそ0 mm、102 mm、204 mmの距離に配置されている。各モジュールの構造内には、デルリン(プラスチック)製の中空円柱が存在し、その内半径は17.0±0.02 mm、外半径は28.0±0.02 mm、高さは19.0±0.02 mmである。この中空円柱の内半径範囲内の中央部には、公称値で高さ13 mmの空気の領域が存在し、この中空円柱の周りを10 mmの空気の領域が取り囲んでいる。中空円柱の6 mm上方には、高さ10.0±0.1 mm、直径34.0±0.1 mmの均質なテフロン製の円柱が存在する。さらに、中空円柱の6 mm下方には、前述のテフロン円柱と同精度で設計された均質なアクリル製の円柱が存在する。また、このファントムの外表面には、アイソセンターやアライメント調整用の目印がある。
American College of Radiology(ACR)から認定された、もしくはCT装置メーカーから提示された日常のキャリブレーションチェックを合格した後であれば、ファントムスキャンはいつでも実施可能である。
評価者は、アイソセンターに最も近いモジュールを用いて上述の6つの画質特性を計算する。さらに、アイソセンターから160.0 mmにモジュールが位置すると想定した場合の画質特性も計算する。アイソセンターから160.0 mmの位置にモジュールがあるとすると、内半径が17.0 mm、外半径が28.0 mmであるため、アイソセンターから132.0~188.0 mmの距離の範囲で画質特性を計算することになる。この評価は、アイソセンターから102mmに位置する中央のモジュールとアイソセンターから204mmの最も遠い位置にあるモジュールで計測した値から線形補間することによって得られる。
分解能 (Resolution)は、QIBA承認リファレンスオブジェクトをスキャンした後、3D Gaussian PSF sigmaを測定することで計算される。このPSF sigmaは、リファレンスオブジェクト内部の中空円柱部分、その表面近くの部分体積効果を伴ったボクセルデータに対してガウス分布を三次元的に最良適合させることで求められる。求められたX、Y PSF sigmaは面内分解能を表し、Z PSF sigmaはZ軸方向の分解能を表す。どちらも単位はmmである。3D PSF sigma ellipsoid volume(PSFV)は、X、Y、Z軸方向のPSF sigmaを軸半径とする楕円体の体積として計算され、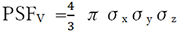 で計算される。PSFVの単位はmm3であり、この値が小さくなると分解能が向上することを示す。QIBA承認リファレンスオブジェクトは、同心円筒の形状をしており、X-Z撮影面に対して平置きして使用される。この時、同心円筒の内側表面が、面内分解能とZ軸方向の分解能の両方を測定するために使用される。50%カットオフ周波数における変調伝達関数の値(MTF 50)は、次の式を使用することで、面内PSF sigma(In-plane Point Spread Function sigma)に変換することができる(46)。
で計算される。PSFVの単位はmm3であり、この値が小さくなると分解能が向上することを示す。QIBA承認リファレンスオブジェクトは、同心円筒の形状をしており、X-Z撮影面に対して平置きして使用される。この時、同心円筒の内側表面が、面内分解能とZ軸方向の分解能の両方を測定するために使用される。50%カットオフ周波数における変調伝達関数の値(MTF 50)は、次の式を使用することで、面内PSF sigma(In-plane Point Spread Function sigma)に変換することができる(46)。
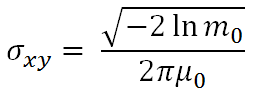
ここで、m0は空間周波数μ0 [lp/mm]のときのMTF値である。したがって、PSFからMTFへの変換は次のようになる。
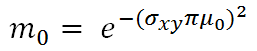
分解能アスペクト比は2.0を超えてはならない。
HUバイアス (HU Bias)は、ある特定の物質に対して計算される。まず、QIBAリファレンスオブジェクトの内部にあるボクセルに対してHU濃度の平均を計測する。このオブジェクト(の均質部分)を使用することで、部分容積効果による測定への影響はなくなる。計測された各ボクセルは、このリファレンスオブジェクトの外表面から2 × sigmaミリメートルより離れている必要がある。これは、部分容積効果による濃度の偏りを避けるためである。次に、その物質から期待されるHU濃度(CT値)を、求めた平均HU値から差分することで、HU値の偏差(HUバイアス)が算出される。HUバイアスを計測するための物質は、空気とアクリルの2種類であり、その単位はHUである。
ボクセルノイズ (Voxel Noise)は、ある物質に対して計算される。QIBAリファレンスオブジェクトの内部にあるボクセルに対してHU濃度の標準偏差を計測する。このオブジェクト(の均質部分)を使用することで、部分容積効果による測定への影響はなくなる。測定される各ボクセルは、同心円筒の外表面から2 × sigmaミリメートルより離れている必要がある。これは、部分容積効果によるアーチファクトを回避するためである。ボクセルノイズ(Voxel Noise)を計測する物質は、アクリルである。
エッジ強調 (Edge Enhancement)に関して、QIBAが承認する一手法を説明する。この手法は、±10度の円弧状サンプリングパスの平均HU濃度を計測することによって求められる。この時のサンプリングパスは、X軸上にある中空円柱の中心から放射状に距離を変化させた位置で、またX-Z撮像面に対して、見かけ上、平置きされた状態の中空円柱リファレンスオブジェクトの内部で形成される。計測された平均HU濃度の最大値から空気領域の平均HU濃度を差分した値は、エッジ強調(Edge Enhancement)を求めるための最大観測コントラスト(EEm)を表している。エッジ強調(Edge Enhancement)のリファレンスレベル(EEr)は、デルリン部の平均HU濃度から空気部の平均HU濃度の差分することで計算される。これらにより、最終的なエッジ強調値は、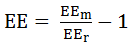 として計算される。
として計算される。
空間歪み (Spatial Warping)は、次のQIBAが承認する方法を使用して計算される。この方法は、ある位置において、理想的な幾何学的円柱の表面に対するデルリン製中空円柱の外側表面の二乗平均平方根誤差(Root Mean Square Error; RMSE)を計算することによって求められる。ここで、真値となる理想的なリファレンスオブジェクトの表面には、蓋のない完璧な円柱のジオメトリが使用される。また、実測値となる円柱の外側表面の決定には、デルリンの平均HU濃度と空気の平均HU濃度の中間を閾値としたマーチングキューブ法が使用される。
3つの画質評価モジュールがFOV内に入らないような、小さなFOVを用いた撮影プロトコールを使用する場合、3つすべてのモジュールで適合性を示す2つ目のプロトコールを準備する必要がある。2つのプロトコールを組み合わせて、1つは大きな患者用、もう1つは小さなFOV内に収まる患者用として、プロファイルの適合性を実証するために使用される。
4.1.2 結節解析ソフトウェアの特性
結節計測ソフトウェアアプリケーションの最低限の品質を評価する方法を次に示す。計測の品質は、2つの指標で評価される。
- 計測バイアスは、体積計測の真の値からの平均値の偏差である。この指標は、幾何学的オブジェクトの撮影を繰り返し、その体積を計測することによって評価される。オブジェクトは、さまざまなサイズと形状で製造され、体積が検証されて判明しているものを用いる。
- 変動係数(CV)は、オブジェクトの体積計測を繰り返した場合の変動の尺度であり、計測値の標準偏差と平均値の比として計算される。さまざまなサイズ、形状、アタッチメントを持つ小結節を短い間隔で撮影を繰り返して体積を計測する。また、幾何学的オブジェクトでも撮影と体積計測を行う。
結節解析ソフトウェア評価方法の例を次に示す。評価者は、QIBA Small Lung Nodule Profile WikiページのConformance Materialsセクションにあるリンクから入手できる2セットのCT画像を取得する。「ファントム結節データセット」には、QIBAが提供するファントムの多数の幾何学的オブジェクトが、フォームまたはQIBA承認の参照オブジェクトに埋め込まれた、10件のCT画像が含まれる。「臨床結節データセット」には、体積変化の量がほぼ0になるように短い時間間隔内で取得された、形状とサイズが異なる14種類の肺結節を含む、5件のCT画像が含まれる。
QIBA Small Lung Nodule Profile WikiページのConformance Materialsセクションでは、2つのスプレッドシートファイルも利用できる。xls形式の「オブジェクト位置ファイル」には、「ファントム結節データセット」内の幾何学的オブジェクトのRAS座標が提供される。xls形式の「計測レポートファイル」は、計測する各オブジェクトの体積計測データ入力フォーマットである。
「ファントム結節データセット」および「臨床結節データセット」の各CT画像シリーズを結節計測ソフトウェアにロードし、体積計測を行う。各計測値を「計測報告ファイル」に入力すると、計測された値がプロファイルに適合するかどうか自動的に次のように検証される。まず、幾何学的オブジェクトの各体積計測値のバイアスが、そのオブジェクトの真値の5%未満であり、95%の信頼度であるかどうか検証する。そして、幾何学的オブジェクトと肺結節の両方の変動係数がTable 1の値を超えないことを、95%の信頼度で検証する。また、解析ソフトウェアの名前とバージョン番号を「計測報告ファイル」に入力し、QIBA Small Lung Nodule Profile WikiページのConformance Materials SectionにリストされているQIBA品質保証サイトにファイルをアップロードする。真値(X値)で計測値(Y値)を回帰することにより、計測の線形性が検証される。R2 ≧ 0.9かつ2次項がゼロに近い場合、線形性の条件を満たす。回帰勾配は1.0に近い(つまり、勾配の95%信頼区間が0.95~1.05に含まれている)必要がある。肺結節解析ソフトウェアの特定のバージョンについて、2つの独立した実施施設がこれらの手順を正常に実行したときに、プロファイルに適合していると見なされる。
実施施設は、ベンダーの装置の手順に従って、リストにないソフトウェアの適合性を検証することができる。
4.2 ベンダーの適合性評価手順
装置および解析ソフトウェアのベンダーは、このプロファイルに適合するために、このSectionの評価手順に従う必要がある。ベンダーの評価手順は実施施設での評価と同じ方法とツールを使用するが、より厳密になるように設計されている。ベンダーによる装置の徹底的なテストと、実施施設における多数のフィールドテストを組み合わせることで、このプロファイルの要件を満たすことが保証される。
4.2.1 装置ベンダー評価手順
装置ベンダーは、まず、実施施設で自社の装置を使用するための推奨プロトコールを確立する。このプロファイルではプロトコール設定のわずかな変更(たとえば、患者ごとに異なるmA設定の使用)は許可されているため、装置ベンダーはプロトコールに一般的な変更を加えて撮影しても、このプロファイルの要件が満たされることを確認する必要がある。実験計画法(Design of Experiments;DOE)を使用して、推奨プロトコールをさまざまな条件下で装置の性能を評価する。
装置ベンダーは、次の手順を実行して、特定の装置モデルがこのプロファイルに準拠することを実証する。
- 評価するための臨床的に動作するCT装置・モデルを決定する。
- そのモデルにおけるベンダー推奨撮影プロトコールを1つまたは複数定義する。各ベンダーが推奨する撮影プロトコールは、Section4.1 の手順で得られる自動画質レポートを取得して合格し、このプロファイルの要件を満たす必要がある。もしくはQIBAが承認する別の方法で、このプロファイルの要件を満たすことを確認する必要がある。
- ベンダー推奨撮影プロトコールごとに、mAs、FOV、ピッチ、逐次近似再構成法を使う場合はその再構成の設定(逐次近似法を使わない場合はテーブル高)について、24のfull factorial DOEを定義・実行する。さらに、推奨撮影プロトコールに対して3回繰り返し撮影を行う。例えば、下のTable 2の設定を使用した推奨CT撮影プロトコールではTable 3のように推奨撮影プロトコール3回(A, B, C)とmAs、FOV、ピッチ、逐次近似法の設定を体系的に変更した16回の合計19回の撮影を行う。
Table 2:撮影プロトコールの例
| mAs | 40 |
| kVp | 100 |
| ローテーションタイム (s) | 0.50 |
| FOV (cm) | 35.0 |
| ピッチ | 1.50 |
| スライス厚 (mm) | 1.00 |
| スライス間隔 (mm) | 0.75 |
| 再構成関数 | I40-4 |
| テーブル高 | Centered |
Table 3: Design of experiments (DOE) の例
| Experiment # | mAs | FOV | Pitch | Iterative Recon Setting | Notes |
|---|---|---|---|---|---|
| A | 40 | 35.0 | 1.50 | I40-4 | Repetition 1 |
| 01 | 30 | 30.0 | 1.25 | I40-3 | [ -, -, -, - ] |
| 02 | 30 | 30.0 | 1.25 | I40-5 | [ -, -, -, + ] |
| 03 | 30 | 30.0 | 1.75 | I40-3 | [ -, -, +, - ] |
| 04 | 30 | 30.0 | 1.75 | I40-5 | [ -, -, +, + ] |
| 05 | 30 | 40.0 | 1.25 | I40-3 | [ -, +, -, - ] |
| 06 | 30 | 40.0 | 1.25 | I40-5 | [ -, +, -, + ] |
| 07 | 30 | 40.0 | 1.75 | I40-3 | [ -, +, +, - ] |
| 08 | 30 | 40.0 | 1.75 | I40-5 | [ -, +, +, + ] |
| B | 40 | 35.0 | 1.50 | I40-4 | Repetition 2 |
| 09 | 50 | 30.0 | 1.25 | I40-3 | [ +, -, -, - ] |
| 10 | 50 | 30.0 | 1.25 | I40-5 | [ +, -, -, + ] |
| 11 | 50 | 30.0 | 1.75 | I40-3 | [ +, -, +, - ] |
| 12 | 50 | 30.0 | 1.75 | I40-5 | [ +, -, +, + ] |
| 13 | 50 | 40.0 | 1.25 | I40-3 | [ +, +, -, - ] |
| 14 | 50 | 40.0 | 1.25 | I40-5 | [ +, +, -, + ] |
| 15 | 50 | 40.0 | 1.75 | I40-3 | [ +, +, +, - ] |
| 16 | 50 | 40.0 | 1.75 | I40-5 | [ +, +, +, + ] |
| C | 40 | 35.0 | 1.50 | I40-4 | Repetition 3 |
- DOEの各実験について、装置ベンダーは自動画質レポートを取得して合格し、このプロファイルの要件を満たす必要がある。もしくはQIBAが承認する別の方法で、このプロファイルの要件を満たすことを確認する必要がある。ベンダーには、自動分析のために複数のスキャンをアップロードする機能が提供される。
- 装置モデルと推奨撮影プロトコールは、DOEでのすべての実験が自動画質検証で合格したとき、または別のQIBA承認の方法で確認されたときに、プロファイルに準拠していると見なされる。DOEでテストされたバリエーションにより、装置モデルがこのプロファイルをサポートしていることを示す動作範囲表(operating envelope)が作成される。ベンダーは、DOEの変数を追加して実験を繰り返して適合性を評価し、動作範囲表のカバーする範囲を拡大してもよい。
これらの手順を完了したものは、検証済みの適合CT装置モデルと推奨撮影プロトコールとして、QIBA Small Lung Nodule Profile WikiページのClinical Site Conformanceセクションにリストされる。
4.2.2 解析ソフトウェアベンダー評価手順
解析ソフトウェアは、一連のテストデータセットに対して実行され、体積計測が最低限の性能を持つことを確認される。データセットには、体積が既知の幾何学的オブジェクトを含むファントムスキャン(ファントム結節データセット)と、臨床的に変化のない症例の結節のデータセット(臨床結節データセット)が含まれる。
ファントム結節データセットは、精密に製造された楕円体を用いたQIBA CT肺結節ファントムの修正バージョンによって得られたものである。修正バージョンでは2つの楕円体モジュールが追加されており、Figure 2にその配置を示す(黄色で表示)。追加の楕円体モジュールのサイズは、ともに直径76.4 mm、高さ50.8 mmである。アイソセンターにある標準モジュールの下に追加されたモジュールの内部には、アクリル製楕円体を含むEVAフォーム製の円柱が存在する。この円柱は上部、中部、下部に分かれており、上部には、直径10.0 × 6.0 × 6.0 mmの、中部には、直径9.0 × 5.4 × 5.4 mmの、下部には、直径8.0 × 4.8 × 4.8 mmの16個のアクリル製楕円体が含まれている。もう一つの追加の楕円体モジュールは上部と下部に分かれており、上部には、直径7.0 × 4.2 × 4.2 mmの、下部には、直径6.0 × 3.6 × 3.6 mmのアクリル製楕円体が含まれている。すべての楕円体は、± 0.02 mmの最大直径公差で製造されている。

Figure 2: QIBA CT肺結節ファントムの修正バージョン(解析ソフトウェア適合性検証のために2つのモジュールが追加されている)
Figure 3に、円柱内のアクリル製楕円体の配置を示す。すべての楕円体は、円柱内の同じ相対位置に配置されている。
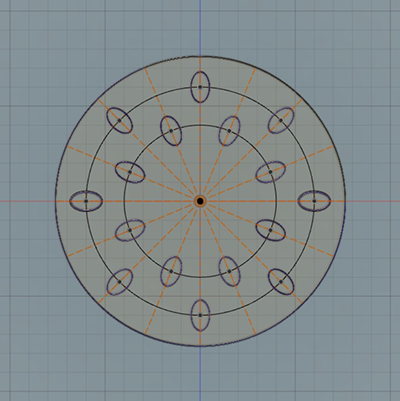
Figure 3: 円柱内のアクリル製楕円体の配置例。この例では8.0 × 4.8 × 4.8 mm のサイズのアクリル楕円体の配置を示している。
ファントム結節データセットおよび臨床結節データセットと、解析ソフトウェア用の計測結果のテンプレートとなるスプレッドシートをQIBA Small Lung Nodule Profile WikiページのConformanceセクションのリンクからダウンロードできる。このスプレッドシートは、ソフトウェアの計測値のためのRAS座標とデータプレースホルダーを提供するものである。
解析ソフトウェアの適合性テストの結果は、テストされたソフトウェアのバージョンにのみ適用される。
ファントム結節データセットの解析ソフトウェアテストは、次の手順で構成されている。
- ファントム結節データセット内の各CT画像シリーズを解析ソフトウェアに順次ロードし、結節の自動または半自動セグメンテーションを実行する。
- 計算された体積計測値をスプレッドシートに入力する。計測値がスプレッドシートに入力されると、各結節のバイアスと変動係数が自動的に計算される。
- すべての計測値が計算された結果、すべてのバイアスと変動係数の値は、このプロファイルの許容範囲内でなければならない。つまり、体積バイアスが95%の信頼性をもってファントム結節の真の体積の5%以下であること、変動係数の95%信頼区間の上限の値がTable 1の値未満であること、を満たさなければならない。
臨床結節データセットの解析ソフトウェアテストは、次の手順で構成されている。
- 臨床結節データセット内の各CT画像シリーズを解析ソフトウェアに順次ロードし、結節の自動または半自動セグメンテーションを実行する。
- 計算された体積計測値をスプレッドシートに入力する。計測値がスプレッドシートに入力されると、各結節の変動係数が自動的に計算される。
- すべての計測値が計算された結果、すべての変動係数の値は、このプロファイルの許容範囲内でなければならない。つまり、変動係数の95%信頼区間の上限の値がTable 1の値未満でなければならない。
これらの手順を完了した解析ソフトウェア(バージョン番号を含む)は、検証済みのプロファイルに適合した結節解析ソフトウェアとしてQIBA Small Lung Nodule Profile WikiページのConformanceセクションにリストアップされる。
4.3 実施施設適合チェックリスト
実施施設が以下のチェックリスト手順に従うことで、このプロファイルに準拠することが示される。プロファイルの要件に関する詳細な技術情報はSection 3で提供されている。
| 肺結節計測の準備 | |||
|---|---|---|---|
| Step | 説明 | アクター | 適合 |
| 1.0 | CT装置と肺結節解析ソフトウェアの検証 肺癌検診の結節計測に使用される各CT装置、各解析ソフトウェアについて下記を確認する。 |
||
| 1.1 | CT装置のメーカー名とモデル名が、QIBA Small Lung Nodule Profile WikiページのConformance SectionにあるQIBA検証済みリストにあることを確認する。 | 放射線科医 |
|
| 1.2 | バージョン番号を含むソフトウェア名が、QIBA Small Lung Nodule Profile WikiページのConformance SectionにあるQIBA検証済みリストにあることを確認する。 | 放射線科医 |
|
| 2.0 | CT 品質保証と肺癌検診プロトコールの検証 肺癌検診の結節計測に使用する各CT装置について下記を確認する。 |
||
| 2.1 | CT装置がFDAで承認されていること、ACR CT認定を満たしていること、メーカーによる導入・メンテナンスの要件を満たしていることを確認する。 | 医学物理士 |
|
| 2.2 | CT肺癌検診プロトコールを決定し、CT装置に保存する。既存の肺癌検診プロトコールを使用してもよいし、QIBA Small Lung Nodule Profile WikiページのConformance SectionでQIBAが提供するリストにあるプロトコールから選択することもできる。 | 放射線科医 and 放射線技師 |
|
| 2.3 | 保存されたCT肺癌検診プロトコールでQIBA CTリファレンスオブジェクトを撮影する。 | 射線技師 |
|
| 2.4 | QIBA Small Lung Nodule Profile WikiページのConformance SectionにあるサイトにCTリファレンスオブジェクトの撮影データを送信し、自動画質検証をうけて、合格レポートを取得する。合格レポートが取得できない場合は、合格レポートが取得されるまでステップ2.1から2.4を繰り返す。 | 放射線科医 or 放射線技師 or 医学物理士 |
|
| 3.0 | CT 結節解析ソフトウェアの検証 肺癌検診の結節計測に使用される各解析ソフトウェアについて下記を確認する。 |
||
| 3.1 | CT結節解析ソフトウェアがFDA承認済みであることを確認する。 | 放射線科医 or 画像解析者 |
|
| 3.2 | QIBA Small Lung Nodule Profile WikiページのConformance Sectionから、実施施設の適合性検証データzipファイルと結節計測スプレッドシートをダウンロードする。体積計測をリストされているすべての結節について実行する。スプレッドシートを、QIBA Small Lung Nodule Profile WikiページのConformance Sectionに記載されている電子メールに送信し、合格レポートを取得する。 | 放射線科医 or 画像解析者 |
|
| 肺結節計測の実施 | |||
| Step | 説明 | アクター | 適合 |
| 4.0 | CT撮影、肺結節セグメンテーションの検証 各肺癌検診撮影と肺結節のフォローアップ撮影について下記を確認する。 |
||
| 4.1 | 体積変化の計測を行う場合、両方の時点で同じCT装置と撮影プロトコールを使用されたことを確認する。 | 放射線科医 |
|
| 4.2 | CT撮影時に経静脈的造影剤がされていないことを確認する。 | 放射線科医 |
|
| 4.3 | 全ての撮影時で、計測対象の結節が充実性であること、最大直径が6-10 mmであること、その表面積の1/3以上が同様のCT値をもつ構造に付着していないこと、検証済みのCT肺結節撮影プロトコールが使用されていることを視覚的に確認する。 | 放射線科医 |
|
| 4.4 | 計測対象の充実性結節の位置で、主要なアーチファクト(モーションアーチファクト、ストリークアーチファクトなど)が存在せず、過剰な画像ノイズがないことを視覚的に確認する。 | 放射線科医 |
|
| 4.5 | 計測時のセグメンテーションエラーがないことを視覚的に確認する。 | 放射線科医 |
|
| 5.0 | 肺結節体積計測値の取得 1回もしくは複数回の各計測について下記を確認する。 |
||
| 5.1 | QIBA Small Lung Nodule Profile WikiページのConformance Sectionで利用可能なQIBA small lung nodule Profileオンライン計算機を使用して、各肺結節における計測値とその変化の程度を確認する。 | 放射線科医 |
|
参考文献:
- Henschke CI, Yankelevitz DF, Libby DM, Pasmantier MW, Smith JP, Miettinen OS. Survival of patients with stage I lung cancer detected on CT screening. N Engl J Med. 2006; 355(17):1763-71.
- Aberle DR, Adams AM, Berg CD, et al. Reduced lung-cancer mortality with low-dose computed tomographic screening. N Engl J Med. 2011; 365(5):395-409.
- Yankelevitz DF, Reeves AP, Kostis WJ, Zhao B, Henschke CI. Small pulmonary nodules: volumetrically determined growth rates based on CT evaluation. Radiology. 2000; 217(1):251-6.
- Bolte H, Jahnke T, Schafer FK, et al. Interobserver-variability of lung nodule volumetry considering different segmentation algorithms and observer training levels. Eur J Radiol. 2007; 64(2):285-95.
- Gierada DS, Pilgram TK, Ford M, et al. Lung cancer: interobserver agreement on interpretation of pulmonary findings at low-dose CT screening. Radiology. 2008; 246(1):265-72.
- van Klaveren RJ, Oudkerk M, Prokop M, et al. Management of lung nodules detected by volume CT scanning. N Engl J Med. 2009; 361(23):2221-9.
- Singh S, Pinsky P, Fineberg NS, et al. Evaluation of reader variability in the interpretation of follow-up CT scans at lung cancer screening. Radiology. 2011; 259(1):263-70.
- Petrick N, Kim HJ, Clunie D, et al. Comparison of 1D, 2D, and 3D nodule sizing methods by radiologists for spherical and complex nodules on thoracic CT phantom images. Acad Radiol. 2014; 21(1):30-40.
- Mulshine JL, Gierada DS, Armato SG, 3rd, et al. Role of the Quantitative Imaging Biomarker Alliance in optimizing CT for the evaluation of lung cancer screen-detected nodules. J Am Coll Radiol. 2015; 12(4):390-5.
- Das M, Muhlenbruch G, Katoh M, et al. Automated volumetry of solid pulmonary nodules in a phantom: accuracy across different CT scanner technologies. Invest Radiol. 2007; 42(5):297-302.
- Ravenel JG, Leue WM, Nietert PJ, Miller JV, Taylor KK, Silvestri GA. Pulmonary nodule volume: effects of reconstruction parameters on automated measurements--a phantom study. Radiology. 2008; 247(2):400-8.
- Goo JM, Tongdee T, Tongdee R, Yeo K, Hildebolt CF, Bae KT. Volumetric measurement of synthetic lung nodules with multi-detector row CT: effect of various image reconstruction parameters and segmentation thresholds on measurement accuracy. Radiology. 2005; 235(3):850-6.
- Chen B, Barnhart H, Richard S, Colsher J, Amurao M, Samei E. Quantitative CT: technique dependence of volume estimation on pulmonary nodules. Phys Med Biol. 2012; 57(5):1335-48.
- Larici AR, Storto ML, Torge M, et al. Automated volumetry of pulmonary nodules on multidetector CT: influence of slice thickness, reconstruction algorithm and tube current. Preliminary results. Radiol Med. 2008; 113(1):29-42.
- Xie X, Willemink MJ, de Jong PA, et al. Small irregular pulmonary nodules in low-dose CT: observer detection sensitivity and volumetry accuracy. AJR Am J Roentgenol. 2014; 202(3):W202-9.
- Willemink MJ, Leiner T, Budde RP, et al. Systematic error in lung nodule volumetry: effect of iterative reconstruction versus filtered back projection at different CT parameters. AJR Am J Roentgenol. 2012; 199(6):1241-6.
- Wielputz MO, Lederlin M, Wroblewski J, et al. CT volumetry of artificial pulmonary nodules using an ex vivo lung phantom: influence of exposure parameters and iterative reconstruction on reproducibility. Eur J Radiol. 2013; 82(9):1577-83.
- Chen B, Barnhart H, Richard S, Robins M, Colsher J, Samei E. Volumetric quantification of lung nodules in CT with iterative reconstruction (ASiR and MBIR). Med Phys. 2013; 40(11):111902.
- Wormanns D, Kohl G, Klotz E, et al. Volumetric measurements of pulmonary nodules at multi-row detector CT: in vivo reproducibility. Eur Radiol. 2004; 14(1):86-92.
- Goodman LR, Gulsun M, Washington L, Nagy PG, Piacsek KL. Inherent variability of CT lung nodule measurements in vivo using semiautomated volumetric measurements. AJR Am J Roentgenol. 2006; 186(4):989-94.
- Gietema HA, Schaefer-Prokop CM, Mali WP, Groenewegen G, Prokop M. Pulmonary nodules: Interscan variability of semiautomated volume measurements with multisection CT-- influence of inspiration level, nodule size, and segmentation performance. Radiology. 2007; 245(3):888-94.
- Rampinelli C, De Fiori E, Raimondi S, Veronesi G, Bellomi M. In vivo repeatability of automated volume calculations of small pulmonary nodules with CT. AJR Am J Roentgenol. 2009; 192(6):1657-61.
- de Hoop B, Gietema H, van Ginneken B, Zanen P, Groenewegen G, Prokop M. A comparison of six software packages for evaluation of solid lung nodules using semi-automated volumetry: what is the minimum increase in size to detect growth in repeated CT examinations. Eur Radiol. 2009; 19(4):800-8.
- Marchiano A, Calabro E, Civelli E, et al. Pulmonary nodules: volume repeatability at multidetector CT lung cancer screening. Radiology. 2009; 251(3):919-25.
- Ko JP, Berman EJ, Kaur M, et al. Pulmonary Nodules: growth rate assessment in patients by using serial CT and three-dimensional volumetry. Radiology. 2012; 262(2):662-71.
- Henschke CI, Yankelevitz DF, Yip R, et al. Tumor volume measurement error using computed tomography imaging in a phase II clinical trial in lung cancer. J Med Imaging (Bellingham). 2016; 3(3):035505.
- Das M, Ley-Zaporozhan J, Gietema HA, et al. Accuracy of automated volumetry of pulmonary nodules across different multislice CT scanners. Eur Radiol. 2007; 17(8):1979-84.
- Coenen A, Honda O, van der Jagt EJ, Tomiyama N. Computer-assisted solid lung nodule 3D volumetry on CT: influence of scan mode and iterative reconstruction: a CT phantom study. Jpn J Radiol. 2013; 31(10):677-84.
- ACR-STR. ACR-STR practice parameter for the performance and reporting of lung cancer screening thoracic computed tomography (CT). 2014.
- Honda O, Johkoh T, Sumikawa H, et al. Pulmonary nodules: 3D volumetric measurement with multidetector CT--effect of intravenous contrast medium. Radiology. 2007; 245(3):881-7.
- Rampinelli C, Raimondi S, Padrenostro M, et al. Pulmonary nodules: Contrast-enhanced volumetric variation at different CT scan delays. AJR Am J Roentgenol. 2010; 195(1):149-54.
- Toth T, Ge Z, Daly MP. The influence of patient centering on CT dose and image noise. Med Phys. 2007; 34(7):3093-101.
- Kaasalainen T, Palmu K, Reijonen V, Kortesniemi M. Effect of patient centering on patient dose and image noise in chest CT. AJR Am J Roentgenol. 2014; 203(1):123-30.
- Goo JM, Kim KG, Gierada DS, Castro M, Bae KT. Volumetric measurements of lung nodules with multi-detector row CT: effect of changes in lung volume. Korean J Radiol. 2006; 7(4):243-8.
- Petkovska I, Brown MS, Goldin JG, et al. The effect of lung volume on nodule size on CT. Acad Radiol. 2007; 14(4):476-85.
- Nietert PJ, Ravenel JG, Leue WM, et al. Imprecision in automated volume measurements of pulmonary nodules and its effect on the level of uncertainty in volume doubling time estimation. Chest. 2009; 135(6):1580-7.
- Gavrielides MA, Zeng R, Myers KJ, Sahiner B, Petrick N. Benefit of overlapping reconstruction for improving the quantitative assessment of CT lung nodule volume. Acad Radiol. 2013; 20(2):173-80.
- Willemink MJ, de Jong PA, Leiner T, et al. Iterative reconstruction techniques for computed tomography Part 1: technical principles. Eur Radiol. 2013; 23(6):1623-31.
- Willemink MJ, Borstlap J, Takx RA, et al. The effects of computed tomography with iterative reconstruction on solid pulmonary nodule volume quantification. PLoS One. 2013; 8(2):e58053.
- Revel MP, Lefort C, Bissery A, et al. Pulmonary nodules: preliminary experience with three-dimensional evaluation. Radiology. 2004; 231(2):459-66.
- Petrou M, Quint LE, Nan B, Baker LH. Pulmonary nodule volumetric measurement variability as a function of CT slice thickness and nodule morphology. AJR Am J Roentgenol. 2007; 188(2):306-12.
- Wang Y, van Klaveren RJ, van der Zaag-Loonen HJ, et al. Effect of nodule characteristics on variability of semiautomated volume measurements in pulmonary nodules detected in a lung cancer screening program. Radiology. 2008; 248(2):625-31.
- Hein PA, Romano VC, Rogalla P, et al. Linear and volume measurements of pulmonary nodules at different CT dose levels - intrascan and interscan analysis. Rofo. 2009; 181(1):24-31.
- Hein PA, Romano VC, Rogalla P, et al. Variability of semiautomated lung nodule volumetry on ultralow-dose CT: comparison with nodule volumetry on standard-dose CT. J Digit Imaging. 2010; 23(1):8-17.
- Gietema HA, Wang Y, Xu D, et al. Pulmonary nodules detected at lung cancer screening: interobserver variability of semiautomated volume measurements. Radiology. 2006; 241(1):251-7.
- Wang GE, Skinner MW, Vannier MW. Temporal Bone Volumetric Image Deblurring in Spiral Computed Tomography Scanning. Academic Radiology. 1995; 2:888-895.
追加参考文献
- Gavrielides MA, Li Q, Zeng R, Myers KJ, Sahiner B, Petrick N. Minimum detectable change in lung nodule volume in a phantom CT study. Acad Radiol. 2013; 20(11):1364-70.
- Bolte H, Riedel C, Jahnke T, et al. Reproducibility of computer-aided volumetry of artificial small pulmonary nodules in ex vivo porcine lungs. Invest Radiol. 2006; 41(1):28-35.
- Bolte H, Riedel C, Muller-Hulsbeck S, et al. Precision of computer-aided volumetry of artificial small solid pulmonary nodules in ex vivo porcine lungs. Br J Radiol. 2007; 80(954):414-21.
- Wang Y, de Bock GH, van Klaveren RJ, et al. Volumetric measurement of pulmonary nodules at low-dose chest CT: effect of reconstruction setting on measurement variability. Eur Radiol. 2010; 20(5):1180-7.
- Bolte H, Riedel C, Knoss N, et al. Computed tomography-based lung nodule volumetry--do optimized reconstructions of routine protocols achieve similar accuracy, reproducibility and interobserver variability to that of special volumetry protocols? Rofo. 2007; 179(3):276-81.
- de Jong PA, Leiner T, Lammers JW, Gietema HA. Can low-dose unenhanced chest CT be used for follow-up of lung nodules? AJR Am J Roentgenol. 2012; 199(4):777-80.
- Christe A, Torrente JC, Lin M, et al. CT screening and follow-up of lung nodules: effects of tube current-time setting and nodule size and density on detectability and of tube current-time setting on apparent size. AJR Am J Roentgenol. 2011; 197(3):623-30.
- Honda O, Sumikawa H, Johkoh T, et al. Computer-assisted lung nodule volumetry from multi-detector row CT: influence of image reconstruction parameters. Eur J Radiol. 2007; 62(1):106-13.
- Young S, Kim HJ, Ko MM, Ko WW, Flores C, McNitt-Gray MF. Variability in CT lung-nodule volumetry: Effects of dose reduction and reconstruction methods. Med Phys. 2015; 42(5):2679-89.
- Ashraf H, de Hoop B, Shaker SB, et al. Lung nodule volumetry: segmentation algorithms within the same software package cannot be used interchangeably. Eur Radiol. 2010; 20(8):1878-85.
- Christe A, Bronnimann A, Vock P. Volumetric analysis of lung nodules in computed tomography (CT): comparison of two different segmentation algorithm softwares and two different reconstruction filters on automated volume calculation. Acta Radiol. 2014; 55(1):54-61.
- Zhao YR, Ooijen PM, Dorrius MD, et al. Comparison of three software systems for semi-automatic volumetry of pulmonary nodules on baseline and follow-up CT examinations. Acta Radiol. 2013; 55(6):691-8.
- Gavrielides MA, Kinnard LM, Myers KJ, Petrick N. Noncalcified lung nodules: volumetric assessment with thoracic CT. Radiology. 2009; 251(1):26-37.
- Marten K, Engelke C. Computer-aided detection and automated CT volumetry of pulmonary nodules. Eur Radiol. 2007; 17(4):888-901.
- Boll DT, Gilkeson RC, Fleiter TR, Blackham KA, Duerk JL, Lewin JS. Volumetric assessment of pulmonary nodules with ECG-gated MDCT. AJR Am J Roentgenol. 2004; 183(5):1217-23.
Appendices
Appendix A:謝辞と帰属
この文書は、Volumetric Computed Tomography (v-CT) Technical CommitteeのRadiological Society of North America (RSNA) Lung Nodule Volume Assessment and Monitoring in Low Dose CT Screening Working Groupによって提供されている。このワーキンググループは、学界を代表する科学者、画像装置メーカー、画像解析ツールソフトウェア開発者、画像解析研究所、医薬品企業、政府研究機関、専門学会、規制当局などで構成されている。すべての作業は、競争前基礎的共同作業によるものである。
SLN委員会とその作業の詳細については、下記のWebリンクを参照されたい。
QIBASmall Lung Nodule Profile Wiki page
https://qibawiki.rsna.org/index.php/CT_Small_Lung_Nodule_Biomarker_Ctte
CT Small Lung Nodule Volume Assessment and Monitoring in Low Dose CT Screening Committee (アルファベット順):
| Denise Aberle, MD | University of California, Los Angeles (UCLA) |
| Samuel G. Armato III, PhD | University of Chicago |
| Ricardo Avila, MS | Accumetra, LLC |
| Roshni Bhagalia, PhD | GE Global Research |
| Matthew Blum, MD, FACS | University of Colorado Health |
| Kirsten L. Boedeker, PhD | Toshiba Medical Research Institute-USA, Inc. |
| Andrew J. Buckler, MS | Elucid Bioimaging Inc. |
| Paul L. Carson, PhD | University of Michigan Medical Center |
| Dominic Crotty, PhD | GE Healthcare |
| Harry de Koning, MD, PhD | Erasmus University Medical Center |
| Ekta N. Dharaiya, MS | Philips Healthcare |
| Les Folio, DO, MPH | National Institutes of Health (NIH) |
| Matthew Fuld, PhD | Siemens AG Healthcare |
| Kavita Garg, MD | University of Colorado, Denver |
| David S. Gierada, MD | Wahington University Mallinckrodt Institute of Radiology |
| Fergus Gleeson, MBBS | Churchill Hospital—Headington, (Oxford, UK)/ British Society of Thoracic Imaging |
| Gregory V. Goldmacher, MD, PhD, MBA | Merck |
| Jin Mo Goo, MD, PhD | Seoul National University Hospital(South Korea) |
| Tomasz Grodzki, MD, FETCS | Regional Hospital for Lung Diseases/ European Society of Thoracic Surgeons (Poland) |
| Bernice E. Hoppel, PhD | Toshiba Medical Research Institute USA, Inc. |
| Edward F. Jackson, PhD | University of Wisconsin, School of Medicine & Public Health |
| Philip F. Judy, PhD | Harvard-Brigham and Women's Hospital |
| Ella A. Kazerooni, MD | University of Michigan |
| David A. Lynch, MD | National Jewish Health |
| Ashkan A. Malayeri, MD | NIH/CC/DRD |
| Theresa C. McLoud, MD | Massachusetts General Hospital/ Society for Thoracic Radiology |
| Michael McNitt-Gray, PhD | University of California, Los Angeles (UCLA) |
| Steve Metz, PhD | Philips |
| James L. Mulshine, MD | Rush University Medical Center |
| Reginald Munden, MD, DMD, MBA | Houston Methodist Hospital-Physician Organization |
| Nancy Obuchowski, PhD | Cleveland Clinic Foundation |
| Michael O’Connor, MBA, PhD | PAREXEL International |
| Matthijs Oudkerk, MD, PhD | University Medical Center Groningen (the Netherlands) |
| Eric S. Perlman, MD | Perlman Advisory Group, LLC |
| Mathias Prokop, MD, PhD | Radboud University Medical Center (Nijmegen, the Netherlands) |
| James G. Ravenel, MD | Medical University of South Carolina |
| Anthony P. Reeves, PhD | Cornell University |
| Marthony Robins, PhD | Duke University |
| Ehsan Samei, PhD | Duke University |
| Lawrence H. Schwartz, MD | New York Presbyterian Hospital/ Columbia University Medical Center |
| Jenifer Siegelman, MD, MPH | Harvard Medical School Brigham and Women's Hospital |
| Mario Silva, MD | University of Parma (Italy) |
| Gary Smith, MD | Vanderbilt University |
| Daniel C. Sullivan, MD | Duke University |
| Rozemarijn Vliegenthart, MD, PhD | University Medical Center Groningen(the Netherlands) |
| David F. Yankelevitz, MD | Mount Sinai Hospital |
| Lifeng Yu, PhD | Mayo Clinic |
このワーキンググループはRadiological Society of North Americaのスタッフの支援と技術的サポートに深く感謝する。
| Fiona Miller, Director | Department of Research |
| Joseph Koudelik, Assistant Director | Scientific Affairs, Department of Research |
| Julie Lisiecki, Manager | Scientific Affairs, Department of Research |
| Susan Weinmann, Senior Administrative Assistant | Department of Research |
Appendix B:背景
B.1 結節体積計測のaccuracyに関する参考文献のサマリー
http://qibawiki.rsna.org/index.php/Work_Product_for_Review
B.2 結節体積計測のprecisionに関する参考文献のサマリー
http://qibawiki.rsna.org/index.php/Work_Product_for_Review
Appendix C: 計量学的手法に関する参考文献
Obuchowski NA, Buckler A, Kinahan PE, Chen-Mayer H, Petrick N, Barboriak DP, Bullen J, Barnhart H, Sullivan DC. Statistical Issues in Testing Conformance with the Quantitative Imaging Biomarker Alliance (QIBA) Profile Claims. Academic Radiology in press.
Kessler LG, Barnhart HX, Buckler AJ, et al. The emerging science of quantitative imaging biomarkers: terminology and definitions for scientific studies and for regulatory submissions. SMMR 2015; 24: 9-26.
Raunig D, McShane LM, Pennello G, et al. Quantitative imaging biomarkers: a 235 review of statistical methods for technical performance assessment. SMMR 2015; 24: 27- 67.
Obuchowski NA, Reeves AP, Huang EP, et al. Quantitative Imaging Biomarkers: A Review of Statistical Methods for Computer Algorithm Comparisons. SMMR 2015; 24: 240 68-106.