Japan Quantitative Imaging Biomarker Alliance (J-QIBA)
Quantitative Imaging Biomarker
Volumetry
QIBA プロファイル: 進行腫瘍におけるCT体積変化計測
(CT Tumor Volume Change for Advanced Disease: CTV-AD)
- 日本語訳作成:
- 秦 明典,富山 憲幸
目次
解決済みの問題
1 エグゼクティブサマリー
2 臨床的背景と要件
3 プロファイル必要条件
3.1 施設適合性
3.1.1 考察
3.1.2 仕様
3.2 製品検証
3.2.1 考察
3.2.2 仕様
3.3 スタッフの質的評価
3.3.1 考察
3.3.2 仕様
3.4 定期的QA(品質保証)
3.4.1 考察
3.4.2 仕様
3.5 プロトコールデザイン
3.5.1 考察
3.5.2 仕様
3.6 被験者の取り扱い
3.6.1 考察
3.6.2 仕様
3.7 画像データ取得
3.7.1 考察
3.7.2 仕様
3.8 画像データ再構成
3.8.1 考察
3.8.2 仕様
3.9 画像QA(品質保証)
3.9.1 考察
3.9.2 仕様
3.10 画像解析
3.10.1 考察
3.10.2 仕様
4 評価手順
4.1 評価手順:面内空間分解能
4.2 評価手順:ボクセルノイズ
4.3 評価手順:腫瘍体積計測のaccuracy
4.4 評価手順:腫瘍体積の再現性
4.4.1 テスト画像セットの取得
4.4.2 体積計測
4.4.3 統計的性能指標の計算
4.5. 評価手順:腫瘍体積のBiasと線形性
4.5.1 テスト画像セットの取得
4.5.2 体積計測
4.5.3 統計的性能指標の計算
4.6 評価手順:実施施設のパフォーマンス
4.6.1 撮影の検証
4.6.2 テスト画像セット
Appendix
Appendix A:謝辞と帰属
Appendix B:規約と定義
Appendix C:適合性チェックリスト
インストラクション
実施施設チェックリスト
撮影装置と再構成ソフトウェアのチェックリスト
画像解析ツールチェックリスト
放射線科医チェックリスト
物理士チェックリスト
放射線技師チェックリスト
1 エグゼクティブサマリー
QIBAプロファイルは、バイオマーカーを生成するための手引きである。QIBAプロファイルの目標は、バイオマーカーとしての十分な性能を達成することを支援することにある。
プロファイルの作成は段階的なプロセスであり、このプロファイルはコンセンサスの段階にある。性能要件は、専門家のコンセンサスであり、その後の段階で経験的に実証されていくことになる。このプロファイルのユーザーは、背景や文脈を理解するために、http://qibawiki.rsna.org/index.php/QIBA_Profile_Stagesのサイトを参照することを勧める。
Section2 要件(Claim)には、バイオマーカーとしての性能目標が記述してある。
Section3 プロファイル必要条件(Requirement)には、バイオマーカーの生成に必要なアクティビティに求められる条件について書かれている。そのアクティビティにかかわるアクターは要件を達成するために、この必要条件を満たす必要がある。
Section4 評価手順には、必要条件に応じた評価方法が定義されている。
このQIBAプロファイル(進行腫瘍におけるCT体積変化計測)は、腫瘍の進行や治療効果のバイオマーカーとして使用される腫瘍体積の変化に関するものである。アクティビティ(定期的QA、被験者の取り扱い、画像データ取得、画像データ再構成、画像QA、画像解析)に関与するアクター(撮影装置、放射線技師、物理士、放射線科医、再構成ソフトウェア、画像解析ツール)の必要条件を定義している。
必要条件は、十分なaccuracyを達成し、腫瘍体積計測値の変動性を減らすことに焦点を当てている。要件(バイオマーカーの性能目標)は次のとおりである。
ベースラインでの腫瘍の面内長径が50-100mm、35-49mm、10-34mmである場合、計測された変化がそれぞれ24%、29%、39%より大きい場合、95%の信頼性をもって腫瘍体積の真の変化が生じたといえる。
この文書は、このバイオマーカーに基づいて決定を下す臨床医、このバイオマーカーを生成する画像部門のスタッフ、関連製品を開発するベンダーのスタッフ、製品の規制当局、製品の購入者、画像をエンドポイントとして臨床試験をデザインする研究者を支援することを目的としている。
QIBA Webサイトでは、各アクターのSection3の要件を再グループ化したチェックリストも提供している。これにより、施設、スタッフ、および撮影装置のプロファイルへの適合性を簡単に確認できる。
このプロファイルは、要件を達成するための必要条件を記述するものであって、「standard of care (標準的なケア)の必要条件」について記述するものではない。また、このプロファイルへの適合性は、患者の適切なケアのためには二次的なものである。
CT、MRI、PET、超音波を使ったその他の画像バイオマーカーのためのQIBAプロファイルは、qibawiki.rsna.org.で参照可能である。
2 臨床的背景と要件
臨床的背景
胸部腫瘍の体積と経時的変化を定量的に計測する(つまり、異なる時点で取得したCT画像から増大または縮小を評価する)。
すべての関連するスタッフおよび撮影装置は、下記の要件を満たすことで、適合していると判断される(下記のディスカッションを参照)。
要件1:ベースラインでの面内長径が50〜100mmのとき、計測された体積変化が24%より大きい場合、95%の信頼性で腫瘍体積の真の変化が生じた。
要件2:ベースラインでの面内長径が35〜49mmのとき、計測された体積変化が29%より大きい場合、95%の信頼性で腫瘍体積の真の変化が生じた。
要件3:ベースラインでの面内長径が10-34mmのとき、計測された体積変化が39%より大きい場合、95%の信頼性で腫瘍体積の真の変化が生じた。
要件4:腫瘍内変動係数(wCV)として表される腫瘍体積計測性能は、直径50-100mm、35-49mm、10-34mmの腫瘍で、それぞれ0.085、0.103、0.141である。真の体積変化の95%信頼区間の例を下表に示す。
| ベースラインの 体積 (直径) |
フォローアップ時の 体積 (直径) |
体積変化の信頼区間の計算 | 真の体積変化の 95%信頼区間 |
|---|---|---|---|
| 524 cm3 (100mm) | 65 cm3 (50mm) | -459 cm3 ± 88 cm3 | [-547 cm3, -371 cm3] |
| 34 cm3 (40mm) | 268 cm3 (80mm) | 234 cm3 ± 45 cm3 | [189 cm3, 279 cm3] |
| 0.5 cm3 (10mm) | 4.2 cm3 (20mm) | 3.7 cm3 ± 1.2 cm3 | [2.5 cm3, 4.9 cm3] |
真の体積変化は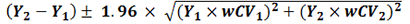 で計算される。Y1、Y2はベースラインとフォローアップ時の計測された体積、wCV1とwCV2 はこれらの計測値の推定変動係数である。
で計算される。Y1、Y2はベースラインとフォローアップ時の計測された体積、wCV1とwCV2 はこれらの計測値の推定変動係数である。
注:表の最初の例では、得られた信頼区間からは524 cm3の腫瘍が547 cm3減少した(=体積が負の値になる)可能性が示唆されてしまうが、これは計測値の変動があり、ベースラインの時点の体積が計測された524 cm3よりも大きかった可能性があるためである。
これらの要件は下記の場合に有効である。
- 腫瘍が両方の時点で計測可能である(つまり、両方の時点の画像で、腫瘍の境界が明瞭で、幾何学的に単純であり、同程度のCT値の構造に付着していない)。
- 腫瘍のサイズは、両方の時点で面内長径10 mm(体積0.5 cm3)〜100 mm(524 cm3)の間である。
考察
免責事項:このプロファイルは胸部腫瘍に適用できるように作成されているが、定量的性能値は肺腫瘍のデータ解析のみから導き出されている。このプロファイルでは、専門家の意見に基づいて、肝臓、リンパ節などの腫瘍でのセグメンテーションと体積計測の性能は、肺腫瘍での性能以上であると考え、その性能が胸部全体にわたって保持されると判断された。
信頼性閾値:
要件1、2、および3の95%の信頼性閾値(±24%、±29%、±39%)は、体積変化の計測に関する「エラーバー」または「ノイズ」と考えることができる。この範囲内の変化が計測された場合、真に変化があったとは判断できない。腫瘍の体積変化がこの範囲を超えた場合、95%の統計的信頼度で、計測の変動性によるものではなく腫瘍のサイズに真の変化があったと考えられる。ただし、これは生物学的に有意な変化であることを示したものではなく、単に計測された変化が真実かどうかの確かさを見ているものである。
臨床的解釈(進行/治療反応性):
要件1、2、3で、95%の信頼度で真の変化が生じたことを示す最小の変化量が説明されている。95%の信頼度で、腫瘍体積の真の増加/減少がある判断するには、ベースラインで50~100mmの間の面内長径の腫瘍においては計測された変化が少なくとも24%でなければならない(他の2つのサイズカテゴリではそれぞれ29%、39%でなければならない)。
臨床的解釈(変化の程度):
真の変化量は、計測された体積変化量の95%信頼区間として、要件4に記載されている(Section3.2.2:結果の信頼区間を参照)。体積がベースラインで34 cm3、フォローアップで268 cm3(直径では40mmから80mmに変化)と計測された場合、真の変化量の95%CIは234 cm3±45の体積の増加になる。信頼区間が0を含む場合は、真の変化が生じたとは結論付けられないことになる。
腫瘍の体積変化が臨床的に有意な腫瘍の増大/縮小であるかどうかは、臨床医の判断を必要とする。現在、定量的体積計測に基づいた検証済みの治療反応性基準はない。固形腫瘍で最も一般的に使用される治療反応性基準であるRECIST 1.1で、一次元的計測値を使用している。RECIST 1.1では、ベースラインから腫瘍径が20%増加したときに進行と判断する。これは、体積では73%の増加に対応する。また、直径が30%減少したときに治療反応性ありと判断する。これは体積では66%の減少に対応する。
腫瘍の面内長径は10~100mmまでと設定されている。下限の10mmの理由は、解像度の限界により部分容積効果が生じることによる変動性を制限するためである。上限の100mmの理由は、腫瘍が大きくなると形態が複雑になったり、他の臓器に浸潤したりすることによる変動があるため、これを制限し、性能評価手順を管理しやすくするためである。
この要件は広範な文献のレビューと専門家のコンセンサスによって作成されているが、この仕様に厳密に準拠する研究によって十分に実証されてはいるわけではない。フィールドテストによるデータが収集され、要件やプロファイルの詳細に対して適切な修正が行われることが期待される。その時には、この項目は削除されるか、再検討される可能性がある。
要件1、2、3、4の性能値は、このプロファイルで容認される変動性の影響を反映している。このプロファイルでは、特定の腫瘍に対して、プロファイルに適合した同じ放射線科医が同じ画像解析ツールを用いて計測を行う必要がある。フォローアップ時とベースライン時で別の放射線科医が計測したり、別の画像解析ツールが使用されたりした場合は、このプロファイルに適合する結果を得るために、ベースライン時の計測を再度行う必要がある。他のアクター(撮影装置、放射線技師、物理士など)については、2つの時点で異なっていてもよい。つまり、ベースラインとフォローアップの検査について同じ撮影装置を使用する必要はない。ただし、これらのアクターについてもベースラインとフォローアップで同一の場合は、計測性能が向上することが期待される。下表Table2-1に撮影装置、放射線科医、画像解析ツールが同じ場合と異なる場合のprecisionを示す。太字の列以外のprecisionはこのプロファイルで要求される値ではない。放射線科医や画像解析ツールが異なる場合、またはプロファイルの他の必要条件が満たされない場合には、計測は臨床的に有用である可能性はあるが、プロファイルには適合しておらず、計測の要件は満たされないことになる。
Table 2-1: 検出可能な腫瘍体積変化の最小値 (Informative)
| 腫瘍径 | 異なる撮影装置 | 同じ撮影装置 | ||||||
| 異なる 放射線科医 |
同じ 放射線科医 |
異なる 放射線科医 |
同じ 放射線科医 |
|||||
| 異なる 解析 ツール |
同じ 解析 ツール |
異なる 解析 ツール |
同じ 解析 ツール |
異なる 解析 ツール |
同じ 解析 ツール |
異なる 解析 ツール |
同じ 解析 ツール |
|
| >50 mm | 43% | 24% | 43% | 24% | 37% | 10% | 37% | 8% |
| 35-49 mm | 67% | 33% | 65% | 29% | 62% | 22% | 60% | 14% |
| 10-34 mm | 139% | 120% | 80% | 39% | 136% | 117% | 75% | 28% |
注:
- 撮影装置のアクターが異なるということは、2つの時点で使用される装置が異なるモデルであったことを意味する。ベンダーが同じでもモデルが異なる場合は異なるアクターとみなされる。シリアル番号は異なるが同じモデルの2つの装置は、同じアクターとみなされる。
- 表にはprecisionが再現性係数として表されている。
- 表のprecisionを超える腫瘍体積変化が計測された場合に、95%の信頼度で真の変化があることを示す。
- 検出可能な最小変化は、次の式から計算できる:
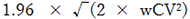
wCVは該当する不確実性の原因から導き出される変動の合計の平方根から推定されたものである(ただし仮定の値で、まだ十分に検証されていない)。 - 変動性の推定値は、ファントムや人間の被験者で行われれた複数の基礎研究から導き出されたものである。
3 プロファイルアクティビティ
このプロファイルはアクターがアクティビティを実施するという形式で記述されている。撮影装置、ソフトウェア、スタッフ、施設などが下表に挙げられるアクターとして、プロファイルへの適合性を求められる。
アクターが各Sectionのすべての必要条件を満たすことで挙げられているアクティビティを実施することができる。
Table 3-1: アクターと求められるアクティビティ
| アクター | アクティビティ | Section |
|---|---|---|
| 実施施設 | 実施施設の適合性 | 3.1 |
| 撮影装置 | 製品検証 | 3.2 |
| 再構成ソフトウェア | 製品検証 | 3.2 |
| 画像解析ツール | 製品検証 | 3.1 |
| 放射線科医 | スタッフの質的評価 | 3.3 |
| プロトコールデザイン | 3.5 | |
| 被験者の取り扱い | 3.6 | |
| 画像QA(品質保証) | 3.9 | |
| 画像解析 | 3.10 | |
| 物理士 | 定期的QA(品質保証) | 3.4 |
| プロトコールデザイン | 3.5 | |
| 放射線技師 | 被験者の取り扱い | 3.6 |
| 画像データ取得 | 3.7 | |
| 画像再構成 | 3.8 |
アクターの責任者である組織の正式な適合要件は、QIBA適合性ステートメントという形式でまとめられる。
撮影装置、再構成ソフトウェア、画像解析ツールなどについてのQIBA適合性ステートメントでは適合性を達成するための構成設定もしくはModel-specificなパラメーター(例えばプロトコール)を記述する必要がある。
このプロファイルの必要条件はstandard of care (標準的なケア)を成文化するものではなく、要件を達するためにある手引きである。このプロファイルの必要条件をみたすことができなかった場合はプロトコールの逸脱となる。ただし、そのような逸脱は、合理的で、避けられないことがある。そして放射線科医や臨床医は、患者や被験者の最大の利益のために必要な場合には、そのような逸脱を許容することが期待される。研究のスポンサーなどが逸脱をどのように扱うかは彼らの判断にまかされる。
装置、再構成ソフトウェア、画像解析ツールのアクターについては、要件への適合性の評価をするのは主に製品開発者であるが、適合性のチェックを必要とするのは実施施設であることがある。例えば、古いモデルの装置を使っている施設が臨床試験に参加するために適合性のステートメントを必要とするが、製品開発者はその古いモデルの販売促進をもはや行っていない、ということが起こりうる。
物理士は関連する仕様の装置性能を管理する責任のある人間であることが望ましい。これはその施設の職員の物理士である場合もあるし、請負業者や装置ベンダーのサービス業者の管理者である場合もある。
このプロファイルに規定されているアクターの流れをFigure 1に示す。
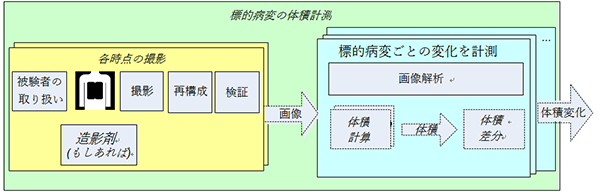
Figure 1: CT腫瘍体積計測 – アクティビティの流れ
腫瘍体積変化の計測方法は、次のようなパイプラインとして説明される。まず、被験者の撮影準備、撮影(RAWデータ取得)、画像再構成、画像の検証が行われ、画像が取得される。このような画像が2つ(またはそれ以上)の時点で取得される。引き続いて画像解析が行われる。各時点の標的腫瘍の体積を計算して差分し、変化の程度を評価する。パーセンテージとして表される場合、体積変化は2つの時点間の体積の差をtime point 1の体積で割ったもので表す。これにより、どちらをtime point 1とするかで非対称性が生じる。例えば、体積の計測値が50cm3 と100 cm3 であった場合、どちらが先かにより、100%の増加もしくは50%の減少という風に表現されることになってしまう。しかし、2つの時点の平均を分母として使用するよりも臨床医にとって馴染みがあると考えられる。
患者管理における体積変化の臨床的解釈の基準は、この文書の範疇外である。標的としての腫瘍の検出と分類もこの文書の範疇外である。
プロファイルの必要条件をみたして要件を達成する性能を持つことを確認するには大きな労力が必要となるが、このプロファイルには変革を妨げる意図はない。上記のようなパイプラインによってリファレンスとなるモデルが得られる。別の手法によるアルゴリズムで、リファレンスモデルと同じ結果を達成できるようなものは容認される。例としては、体積のそのものを計測するのではなく、2つの画像セットでの体積変化を直接計測するような方法が挙げられる。アルゴリズムの開発者は、適切なQIBA委員会と協働して、性能を示すのに必要な評価を行うことが推奨される。
ここに挙げられている必要条件は、性能のベースラインのレベルを規定するものであって、より高い性能のものやより高度な機能をもつものは容認され、かつ、奨励される。このプロファイルは、撮影装置の提供者が必要条件をどのようにみたすということを制限するものではない。
このプロファイルは「病変指向(lesion-oriented)」である。このプロファイルでは、特定の腫瘍の画像を毎回同じ方法で取得して処理する必要がある。腫瘍Aの画像を取得して、腫瘍Bの画像と同じ方法で処理する必要はない。例えば、異なる解剖学的領域の腫瘍は異なる方法で画像化または処理される場合がある。また、腫瘍によって適切な造影相が異なる場合がある。
このプロファイルでは、ベースライン撮影と経過観察時の撮影の設定を一致させることを重視しているため、ベースライン用の撮影パラメーターは特に重要であり、慎重に検討する必要がある。
状況によっては、「ベースライン」は必ずしも患者の最初の撮影時点ではない場合がある。
3.1. 実施施設の適合性
このアクティビティは実施施設のプロファイルへの全体的な適合性の確率について記述されている。また、実施施設に所属する各アクターの適合性を確認するための基準が記述されている。
3.1.1 考察
関連する各アクターがプロファイルで割り振られたアクティビティの必要条件を満たしている場合、実施施設はプロファイルに適合していると判断される。アクティビティは、バイオマーカー値の準備と生成のステップを表す(例:製品検証、システムのキャリブレーション、患者の撮影準備、画像取得、画像解析など)。
実施施設がアクターごとに適合性を評価するためのチェックリストが利用可能である(Appendix C)。このチェックリストではプロファイルのすべての必要条件を抽出し、アクターごと必要条件をまとめている。
実施施設は、一部のアクター(撮影装置など)については、実施施設自体で適合性を確認するのではなく、このプロファイルへの適合を証明するQIBA適合ステートメントを取得できる場合がある。
3.1.2 仕様
| パラメーター | アクター | 必要条件 |
|---|---|---|
| 撮影装置 | 実施施設 | 使用する全ての撮影装置がプロファイルに適合していることを確認する。 |
| 再構成ソフトウェア | 実施施設 | 使用する全ての再構成ソフトウェアがプロファイルに適合していることを確認する。 |
| 画像解析ツール | 実施施設 | 使用する全ての画像解析ツールがプロファイルに適合していることを確認する。 |
| 放射線科医 | 実施施設 | 関与する全ての放射線科医がプロファイルに適合していることを確認する。 |
| 物理士 | 実施施設 | 関与する全ての物理士がプロファイルに適合していることを確認する。 |
| 放射線技師 | 実施施設 | 関与する全ての放射線技師がプロファイルに適合していることを確認する。 |
3.2 製品検証
このアクティビティは、製品としてのアクター(撮影装置、再構成ソフトウェア、画像解析ツール)をこのプロファイルに基づいて使用するにあたっての、工場などでの事前評価に関するものである。このプロファイルの要件を信頼性高く満たすために必要な検証や制度の評価を含め検証や性能評価を含んでいる。
3.2.1 考察
特定のプロトコールにおける性能評価はここには含まれていない。それについてはSection3.5.2に記述されている。
体積計測において、セグメンテーションされたすべてのボクセルの合計で体積が計算される場合もあるし、そうでない場合もある。アルゴリズムによっては、部分容積効果を考慮し、表面の平滑化、腫瘍または臓器のモデリング、またはユーザーによる体積の補間を行う。また、セグメンテーションの前に画像を前処理することもある。モデルベースの推定によって体積が算出される場合もあることに留意する必要がある。
セグメンテーションには、ソフトウェアアルゴリズムによる自動セグメンテーション、人間による手動セグメンテーション、人間の操作を要する半自動セグメンテーションがある。半自動セグメンテーションでは人間が開始シードポイント指定、ストロー指定、領域指定、境界の編集などを行う。
自動セグメンテーションにおいて適切なセグメンテーションができているか画像を見て確認したり、手動セグメンテーションで境界を指定したりするなど、人間がセグメンテーションに関わる場合には、画像の表示条件(ウィンドウ幅とウィンドウレベル)はセグメンテーションをする際に一定にしておくか、後の撮影時(もしくは、臨床試験などで複数の計測者がいて、同じ撮影を異なる計測者が計測を行う場合など)でも一貫性のある表示条件にできるよう文書化しておく必要がある。
腫瘍体積計算では、ソフトウェアが体積を正しく計算していることを確認し、個々の時点でバイアスがないこと確認するために評価される。
腫瘍体積変化の再現性(Repeatability)を評価して、ソフトウェアが一連のテストデータに対して十分に一貫した結果を生成できることを確認する。Repeatabilityとは、同じ条件(同じ撮影装置、撮影プロトコール、計測者、アルゴリズムなど)で異なる対象に対して行われた複数の計測の再現性のことであり、一方、Reproducibilityは1つ以上の条件が変更された場合に行われた複数の計測の再現性のことである。プロファイルの要件としてReproducibilityを達成することに取り組んではいるが、このプロファイルの必要条件はRepeatabilityである。目標とされるRepeatabilityの下記の検討に基づいて選択されている。
- Athelogou M, Kim HJ, Dima A, et al., Algorithm Variability in the Estimation of Lung Nodule Volume From Phantom CT Scans: Results of the QIBA 3A Public Challenge. Acad Radiol 2016.
- Buckler AJ, Danagoulian J, Johnson K, et al., Inter-Method Performance Study of Tumor Volumetry Assessment on Computed Tomography Test-Retest Data. Acad Radiol 2015; 22:1–16.
- Fenimore C, Lu ZQ, McNitt-Gray MF, et al., Clinician sizing of synthetic nodules to evaluate CT interscanner effects. RSNA 2012.
- McNitt-Gray MF, Kim GH, Zhao B, et al., Determining the Variability of Lesion Size Measurements from CT Patient Datasets Acquired Under "No Change" Conditions. Transl Oncol 2015 Feb; 8(1):55-64.
- Petrick NP, PhD, Kim HJ, Clunie DA, et al., Comparison of 1D, 2D, and 3D Nodule Sizing Methods by Radiologists for Spherical and Complex Nodules on Thoracic CT Phantom Images. Acad Radiol 2014; 21:30–40.
計測結果がこのプロファイルで設定された仕様に適合しているのであれば、個々の時点での体積を計算せずに体積変化を直接計算する方法は容認される。
画像解析ツールは、2つの時点のデータを同時に処理し、両方のデータの各腫瘍の画像をマッチさせて体積変化値を算出できるよう設計される必要がある。2つの時点からのデータを別々に処理し、処理の結果をインポートしてマッチさせる方法も考えられるが、このような運用はここでは定義されず、必須ではない。また、そういった方法を前提に運用することはできない。
読影パラダイム(Reading Paradigm:ここで説明するSequential Locked Paradigmなど)では、判断のばらつき(付着した腫瘍をどこで分離するかなどの不一致)による変動性を減らすことができる、潜在的なバイアスがうまれる可能性もある。現在のプロファイルのバージョンでは、既存の製品が不適合になってしまう可能性があるため、画像解析ツールが以前の時点の実際のボリューム値を表示することを禁止していないが、問題の原因になると判断された場合、将来のバージョンでは禁止される可能性がある。また、画像解析ツールは前の時点の画像を表示する機能が必要とされるが、放射線科医はすべてのケースで以前の画像を見る必要はない。その機能をいつ使用するかは、放射線科医の判断にまかされている。
画像解析ツールに異なる時点のセグメンテーション結果と計測結果を保存しておくことで、時間とコストを節約することができる。このためには、データを互換性のある形式で保存・転送する必要がある。DICOMセグメンテーションオブジェクトは腫瘍のセグメンテーションを保存し、DICOM SRオブジェクトは計測結果を保存するのに適切であるが、これらの規格は、このプロファイルでのサポートを必須にするほど広く普及していない。同様に、ベースライン(および過去の撮影時点)のセグメンテーションと計測の結果を転送する機能は、画像解析ツールに導入することを必須とするほど一貫して行われていない。データファイルの管理と転送の運用は、参加実施施設の能力を超える場合がある。
画像解析ツールのような医療ツールは通常、複数のコンポーネント(ハードウェア、オペレーティングシステム、アプリケーションソフトウェア、内部のさまざまな機能ライブラリ)で構成されている。コンポーネントのいずれかでも変更した場合は、そのツールの動作に影響を与える可能性がある。この仕様では、「デバイスバージョン」はコンポーネントのセット全体を反映する必要があり、コンポーネントを変更した場合は、デバイスバージョンの記録も変更される。したがって、このデバイスバージョンは、製造元のドキュメントに記載されている製品リリースバージョンと異なる場合がある。
人間のオペレーターが関与する解析方法(境界の描画・編集、シードポイントの設定、パラメーターの調整など)の場合、オペレーターはシステムの中で計測の再現性に影響を与えるコンポーネントの一つであり、オペレーターが誰であったか記録することが重要である。完全に自動化された解析ソフトウェアではそのような変動性の原因はない。しかし、一般に最終結果に責任を持つのは人間であり、計測を承認または拒否する権限を保持しているため、その身元を記録する必要がある。
以下の腫瘍体積変化のパフォーマンス仕様には、オペレーターのパフォーマンスが含まれており、一般的なオペレーターを前提として評価することを目的としている(つまり、オペレーターのトレーニング歴や経験は標準的であることを前提としている)。メーカーがツールのパフォーマンスを評価する場合や、実施施設での導入時にパフォーマンスを検証する場合に、このことを念頭に置く必要がある。一部の方法では、パフォーマンスがオペレーターの判断とスキルに依存する場合があるが、オペレーターの資格や経験を指定することはこのプロファイルの範疇外である。
結果の信頼区間は、腫瘍体積の変化の真の(もっともらしい)値の範囲を提示する。 95%信頼区間(CI)は、次のように解釈される:2つの時点での腫瘍体積の変化を繰り返し計測し、各計測で95%CIを構築した場合、その%CIの範囲には、95%の確率で腫瘍の真の値が含まれている。
指定の数式の計算機は、次のwebページで入手できる
http://www.accumetra.com/NoduleCalculator.html
オペレーターによって設定されたwCV値を取得し、各体積変化計測値と一緒に計算された95%CIを画面に表示する機能は、計測値をWebツールに転記して計算するよりも、放射線科医にとって便利であるという提案があるが、そのような機能が詳細な証拠を必要とするFDAの製品要件を構成するかどうかは現在不明である。そのため、信頼区間については提案がされている状態であって、プロファイルへの適合の必要条件ではない。
さまざまな詳細事項を記録することは、バイオマーカーとそれを使用する実施施設のパフォーマンスを監査するときに役立つ。たとえば、システムが使用するソフトウェアバージョン、セットアップおよび構成パラメーターを記録したり、DICOMセグメンテーションとして腫瘍セグメンテーション境界を記録できたりすると便利である。モデルベースの計測ツールでは、モデルとパラメーターを記録できる必要がある。現在は、放射線科医がレポートに関連する値を記載することが想定されているため、解析ツールは体積計測値と信頼区間を体系的に記録できる必要はない。
解析ツールが放射線科医による検証のために輪郭を表示するかどうかについては、製品次第である。
3.2.2 仕様
| パラメーター | アクター | 必要条件 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 撮影 プロトコール |
撮影装置 | (メーカーや実施施設でデザインと検証がなされた)プロトコールを作成し、放射線技師が撮影時に利用可能であること。 | ||||||||
| 撮影装置 | Section3.5.2プロトコールデザイン仕様書に適合するプロトコールを準備できること。 | |||||||||
| 撮影装置 | そのプロトコールで、空気と軟部組織のエッジにおけるf50の値が0.3mm-1~0.5mm-1の間の値であること。 4.1 評価手順:面内空間分解能を参照。 |
|||||||||
| 撮影装置 | そのプロトコールでボクセルノイズが標準偏差<60HUであること。 4.2評価手順:ボクセルノイズを参照。 |
|||||||||
| 再構成 プロトコール |
再構成ソフトウェア | Section3.5.2プロトコールデザイン仕様書で規定されるパラメーターをもつ画像を生成できること。 | ||||||||
| Image header | 再構成ソフトウェア | 適合性を達成するために使用されたmodel-specificなパラメーターを含めて、Section3.5.2プロトコールデザイン仕様書に挙げられているDICOMタグの値を、DICOMのImage headerに記録ができること。 | ||||||||
| 多発腫瘍 | 画像解析ツール | 多発腫瘍の計測が可能であること。 計測された各腫瘍を複数の時点で相関させることができること、もしくは放射線科医がそれらを明確に認識できるようにすること。 |
||||||||
| 読影パラダイム (Reading Paradigm) |
画像解析ツール | 比較のために二つの時点の画像を並べて表示できること。 最初の時点を再計測できること(たとえば、別の画像解析ツールまたは放射線科医によって計測された場合などのため)。 |
||||||||
| 腫瘍体積計算 | 画像解析ツール | 真の体積の5%以内を計算できること。 Section 4.3評価手順:腫瘍体積計算を参照。 |
||||||||
| 腫瘍体積再現性 (Repeatability) |
画像解析ツール | 以下のように腫瘍体積の再現性を達成すること:
|
||||||||
| 腫瘍体積のBiasと線形性 | 画像解析ツール | 以下を達成すること:
Section4.5評価手順:腫瘍体積のBiasと線形性を参照。 |
||||||||
| 結果の信頼区間 | 画像解析ツール | 下記の式に基づいて、腫瘍体積変化の95%信頼区間を計算し、利用できるようにすることが推奨される。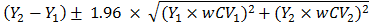 ここで、Y1およびY2は、時点1および2での体積計測結果である。wCV1およびwCV2は、下表で得られるY1とY2の結節内変動係数である。D1、D2は時点1と時点2での面内長径である。
|
Table 3.2.2-1: 全体の再現性係数に基づいた許容される腫瘍体積%Bias
全体の再現性係数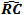 |
許容される全体%Bias (RMSE Target: 7.1%) |
許容されるサブグループ %Bias (RMSE Target: 7.8%) |
|---|---|---|
| 0.05 | 6.60% | 7.32% |
| 0.06 | 6.37% | 7.11% |
| 0.07 | 6.09% | 6.86% |
| 0.08 | 5.75% | 6.56% |
| 0.09 | 5.35% | 6.20% |
| 0.10 | 4.88% | 5.79% |
| 0.11 | 4.30% | 5.31% |
| 0.12 | 3.59% | 4.75% |
| 0.13 | 2.63% | 4.06% |
| 0.14 | 0.84% | 3.17% |
| 0.15 | 0.00% | 1.84% |
| 0.155 | 0.00% | 0.00% |
| 0.16 | n/a (再現性なし) | n/a (再現性なし) |
3.3 スタッフの質的評価
このアクティビティは、人間のアクター(放射線科医、物理士、放射線技師)がこのプロファイルに参加する前に、その能力を評価するものである。プロファイルの要件を満たすために必要なトレーニング、資格、またはパフォーマンス評価が含まれる。
3.3.1 考察
この必要条件は、他のQIBAプロファイルの必要条件と同様に、このプロファイルの要件を達成することに焦点をあてたものである。参加するアクターの医学的、職業的能力の評価はこのプロファイルの範疇外である。
注:放射線科医が画像解析者に計測輪郭を準備させ、放射線科医がその計測輪郭をレビュー・編集する場合、放射線科医のパフォーマンスを検証することが必要条件となる。放射線科医が計測を画像解析者に完全に委任する場合は、画像解析者のパフォーマンスを検証することが必要条件となる。
3.3.2 仕様
| パラメーター | アクター | 仕様 |
|---|---|---|
| 腫瘍体積変化の再現性 (Repeatability) |
放射線科医 | 計測の際に画像解析ツールでオペレーターの操作が必要な場合、下記の腫瘍体積変化の再現性を達成すること:
|
3.4 定期的QA(品質保証)
このアクティビティでは、特定の被験者に関わらない撮影装置の定期的QA(品質保証)が記述されている。 定期的QAには、プロファイルの要件を満たすために必要なキャリブレーション、ファントムイメージング、性能評価、検証が含まれる。
3.4.1 考察
このアクティビティは、撮影装置が正常に調整・キャリブレーションされ、機能していることを確認することに焦点を当てている。 特定のプロトコールのパフォーマンス評価については、ここには含まれず、Section3.5に含まれている。
3.4.2 仕様
| パラメーター | アクター | 仕様 |
|---|---|---|
| 品質管理 (QC) | 物理士 | メーカーの推奨に従って、関連する品質管理(QC)の手順を実行すること。 監査時のために品質管理手順実行の日付/時刻を記録すること。 |
3.5 プロトコールデザイン
このアクティビティは、このプロファイルで用いられる撮影と画像再構成のプロトコールに関するものである。プロファイルの要件を満たすために必要なプロトコール取得や画像再構成のパラメーターに関する制約を含んでいる。
3.5.1 考察
このプロファイルでは、撮影する施設でプロトコールデザインを行うことを想定しているが、他の施設で構築されたプロトコールを使用することもできる。
仕様の決定においては、特定の技術というよりは、データセットにつながる特性に可能な限り焦点を当てた。これは、体格の大きな患者に対して撮影mAsや画像再構成のFOVを増加させる、というような患者の体格に合わせた合理的な調整や製品開発に対して可能な限り柔軟性を持たせるためである。撮影装置や再構成ソフトウェアのQIBA適合性ステートメントに記載された技術的パラメーターセットは、さらなる手引きを必要とする場合に有用である可能性がある。
最小スキャン時間の必要条件の目的は、1回の息止めで必要な解剖学的領域の撮影を可能にし、それによって呼吸によるモーションアーチファクトまたは息止め間の解剖学的ギャップを防ぐことである。この必要条件は、胸部と上腹部のスキャンに適用され、頭部、頸部、骨盤、脊椎、四肢の撮影には必要ない。
ピッチ(IEC Pitch)は、1回の息止めで撮影を完了できるように選択される。
Total Collimation Widthはtotal nominal beam width:N×Tとして定義される。Nは検出器の列数、TはNominal Tomographic Section Thicknessである。たとえば64×1.25mmと計算される。これは、撮影装置のインターフェースでは直接表示されないことがある。Total Collimation Widthが広いと、カバレッジが増加して撮影時間が短縮されるが、コーンビームアーティファクトが発生し、画質が低下する可能性がある。撮影プロトコールは、撮影時間を短くするために十分なカバレッジをもちながら、画質を維持するためにバランスをとるよう検討しなければならない。
Nominal Tomographic Section Thickness(T)はIECが推奨する用語で、シングルコリメーション幅とも呼ばれる。対象のZ軸に沿った空間分解能に影響する。また、画像のノイズにも影響する。
部分的容積効果を低減し、高い空間分解能により高い精度を得るためには、ボクセルサイズは小さいほうが望ましい。解析ソフトウェアにおける解像度/ボクセルサイズは、撮影パラメーターと再構成パラメーターの両方の影響を受ける。ただし、薄いsection thicknessを用いると、画像ノイズが増加する場合がある。
X線CTは電離放射線を利用する。放射線被曝はリスクを伴う可能性があるが、放射線量が減ると、画質が低下する可能性がある。ヘルスケアの専門家が被験者ごとに放射線量のリスクと、画質のバランスを考慮する必要がある。これらのトレードオフを解決することは、このプロファイルの範疇外である。
ここでの撮影パラメーターの制約は、胸部、腹部、骨盤のスキャンを考慮して選択されている。
画像再構成は、QIBAプロファイル内では個別のアクティビティとしてモデル化されている。撮影と密接に関連しており、通常は撮影装置で実行されるが、画像再構成は撮影とは別に実行したり、再実行したりできる。多くの再構成パラメーターは、関連する撮影パラメーターによって影響され、制約をうける。完全に独立しているわけではなく、ある程度分離されたものであるということを考慮に入れた議論の結果、この仕様が記述されている。
多くの再構成パラメーターは、腫瘍の識別、セグメンテーション、計測に直接的または間接的な影響を与える可能性がある。この潜在的な変動性の原因を減らすために、できるだけ多くのパラメーターをベースラインと一致するようにしなければならない。再構成および撮影パラメーターは、サイズ、形状、濃度(density)などの腫瘍特性と相互作用して、体積推定値の結果に影響を与える場合がある。
空間分解能は、空間の詳細を分解する能力を定量化し、部分容積効果の影響をはかることができる。空間分解能が低い場合は、腫瘍の境界を正確に決定することが難しくなる可能性があり、その結果、体積計測のaccuracyとprecisionが低下する。逆に空間分解能が高い場合は、セグメンテーションの質を低下させるノイズの増加を伴うことがある。2つの時点で空間分解能が大幅に異なる場合、これらの影響が変化し、再現性(Repeatability)に影響する可能性がある。したがって、バランスと一貫性の両方が求められる。最大空間分解能は、主に撮影装置のジオメトリ(通常はユーザーの制御下にない)および再構成アルゴリズム/カーネル(ユーザーが選択できる)によって決まる。
分解能は、解像度ファントム(American College of Radiology(ACR)のCT Accreditation Program(CTAP)ファントムのモジュール1など)の撮影で計測された変調伝達関数(MTF)のf50値によって評価される(Section4.1を参照)。ACRファントムを使用して、アイソセンターから1つの距離の位置での分解能を評価すればよい。空間分解能はアイソセンターからの距離に応じて変化する可能性があり、アイソセンターからさまざまな距離に腫瘍が存在する可能性があるが、ここでの分解能の仕様の許容範囲と比較して分解能が大幅に低下することはないと考えられるからである。このプロファイルは、肺と体幹部の他の部位の腫瘍に対応させるため、f50は空気と軟部組織の両方のエッジについて評価される。
ボクセルノイズは、再構成されたCT値のランダムな変動性の大きさを定量化したものである。ノイズが増加すると、人間の手動セグメンテーションでもアルゴリズムの自動セグメンテーションでも腫瘍の境界を特定することが難しくなる。アルゴリズムを一様に「ノイズ耐性」にすると、最大閾値が上がってしまうかもしれない。不適切な画像操作(例:分解能に影響を与えるような極端な画像平滑化)や撮影手法(例:放射線量の増加、解像度の低下)によって画像ノイズを減少させることは、全体として必ずしも有益ではない。(許容される)ノイズの最小閾値については、ノイズ低減と他の項目との間のバランスを強制する手段として導入することもできるが、現時点ではプロファイルではノイズの最小閾値を定義していない。
ボクセルノイズの指標としては、ファントム内の均一な領域で再構成されたCT値の標準偏差が好まれる。標準偏差は再構築関数が異なると変化してしまう可能性があるという問題点もある。ノイズパワースペクトラム(Noise-Power Spectrum)はより包括的な指標であるが、現時点では計算・解釈することは実用的ではない。
ボクセルノイズ(関心領域のピクセル標準偏差)は、特定のmAsでより厚いスライス厚の画像を再構成することで低減できる。各被験者の撮影でボクセルノイズを計測する必要はないが、撮影装置と再構成ソフトウェアは使用する撮影・再構成パラメーターに適合している必要がある。
プロトコールにおける撮影・再構成パラメーターのほとんどには特定の制約が課されていないことに留意すること。これらのパラメーターを大幅に変更すると、ノイズと分解能について不適合になる可能性がある。ノイズと分解能に影響を与えないような変更は有意ではないと見なされる。
また、ほとんどの最新のCT装置は、患者サイズに応じて装置の放射線出力を調整して所定の目標ノイズレベルになるようにするAutomatic Exposure Controlの機能を備えている。 CT装置のノイズ性能は、標準サイズのファントム(American College of RadiologyのCT Accreditation Programファントムなど)でノイズを定量化して評価される。大きなサイズの場合にノイズ性能が十分でなくなるという懸念がある場合は、サイズに応じてさらに評価する。
再構成スライス厚(Reconstructed Image Thickness)は、Z軸方向の名目再構成幅(再構成画像の厚み)である。技術的には厚さは中央と端で同じではない。
再構成画像間隔(Reconstructed Image Interval)は、2つの連続した再構成画像間の距離である。連続データにならなくなるような間隔を用いると、腫瘍の空間的範囲を「切り捨て」、腫瘍境界の識別能を低下させ、腫瘍体積計測の精度を低下させるため、容認されない。オーバーラップ(再構成画像間隔を再構成スライス厚未満にすること)を使用するかどうかは、計測への影響、スループット、画像解析時間、データストレージ容量など、臨床試験の技術的側面を考慮する必要がある。いくつかの研究では、オーバーラップは小さな結節ではaccuracyとprecisionについて利点が大きいことが示されている。
オーバーラップのある間隔で再構成すると、画像枚数が増加し、スループットが低下し、読影時間が延長し、必要なデータストレージ容量が増加する。複数検出器列CT(MDCT)の場合、オーバーラップを使用しても放射線被曝には影響しない。関数、スライス厚、間隔が異なる複数の画像を同じ撮影データ(RAWデータ)から再構成できる。
再構成特性(Reconstruction Characteristics)は、再構成された画像のテクスチャと腫瘍の見た目に影響を与え、計測に影響を与える可能性がある。ここでの特性とは、再構成アルゴリズムのタイプ(filtered back projection (FBP)または逐次近似法)と、アルゴリズムで使用される再構成関数(該当する場合。model-based iterative reconstructionでは関数がない。)を指す。Softな関数は、空間分解能を犠牲にしてノイズを減らすことができる。関数をsharpにすると、ノイズが増加するが、分解能が向上する。関数の特性は、撮影パラメーターおよび再構築アルゴリズムタイプとも相互作用する。低線量撮影でsharpな関数を使うと、逐次近似法よりもFBPで大きな影響がある。組織(肺など)によって、異なる関数が必要になる場合があり、解剖学的領域および撮像された組織に適した関数を使用することが推奨される。単一の研究で複数の関数を使用することは、下記の仕様では禁止されていないが、各時点で一貫した関数を使用して再構成された画像で腫瘍の計測をする必要がある。
時点間のHUの安定性(stability of HU)の体積計測への影響は、このバージョンのプロファイルの執筆時点では完全には理解されていない。
3.5.2 仕様
注:プロトコールのパラメーター決定について、装置ベンダーの推奨する設定を使ってもよいが、放射線科医が責任を負う。また、放射線科医がプロトコールの検証が行われていることを確認する責任がある。検証の責任者は物理士である。物理士は、施設内の医学物理士でもよいし、請負業者やベンダーのサービスエンジニアなどのスタッフでもよい。プロトコールデザインは、物理士と放射線科医の共同で行われ、放射線科医が最終的な責任を負う。 一部のパラメーターはシステムに依存しており、物理士が特別な注意をはらう必要がある場合がある。
| パラメーター | アクター | 仕様 | DICOMタグ |
|---|---|---|---|
| 撮影プロトコール | 放射線科医 | このTableの仕様を満たすプロトコールを準備すること。放射線技師はこのプロファイルの必要条件にある訓練を受けること。 | |
| Total Collimation Width | 放射線科医 | 16mm以上であること | Total Collimation Width (0018,9307) |
| ピッチ (IEC Pitch) | 放射線科医 | 1.5より小さいこと | Spiral Pitch Factor (0018,9311) |
| Nominal Tomographic Section Thickness (T) | 放射線科医 | 1.5mm以下であること。 | Single Collimation Width (0018,9306) |
| 胸部の撮影時間 | 放射線科医 | 必要な解剖学的構造をカバーするのにテーブル移動が必要な場合は、少なくとも4㎝/秒であること。 | |
| 再構成プロトコール | 放射線科医 | このTableの仕様を満たすプロトコールを準備すること。放射線技師はこのプロファイルの必要条件にある訓練を受けること。 | |
| 再構成スライス厚 | 放射線科医 | 0.5~2.5mmにすること。 | Slice Thickness (0018,0050) |
| 画像再構成間隔 | 放射線科医 | 再構成画像スライス厚以下であること (ギャップがないこと、オーバーラップはあってもよい)。 | Spacing Between Slices (0018,0088) |
| 面内空間分解能 | 物理士 | 空気と軟部組織の領域においてf50値が0.3~0.5mm-1であること。 Section4.1評価手順:面内空間分解能を参照のこと。 |
|
| ボクセルノイズ | 物理士 | 標準偏差<60HUを達成すること。 Section4.2評価手順:ボクセルノイズを参照のこと。 |
3.6 被験者の取り扱い
このアクティビティは各時点における被験者の取扱いに関するものである。
3.6.1 考察
このプロファイルでは「subject(被験者)」としているが、必要条件と推奨事項は一般に患者に適用されるものであって、被験者はしばしば患者でもあることに留意すること。
介入アクティビティに関連するタイミング
プロファイルが臨床試験の中で使用される場合、介入アクティビティに関連するタイミングの詳細な手引きや必要条件については、関連する臨床試験プロトコールを参照すること。
交絡アクティビティに関連するタイミング
この文書では、他のアクティビティに関連するタイミングを想定していない。FDG-PETや腹部CTの経口造影剤投与前の絶食は、このプロファイルに悪影響を与えないと考えられている。
造影剤の準備と管理
造影剤の特性は、見た目、視認性、腫瘍体積の定量化に影響する。このプロファイルの基礎となった研究のほとんどは、非造影で実施されたものである。しかし、非造影CTでは、一部の臓器/リンパ節/軟部組織の悪性腫瘍の正確な特性評価と腫瘍境界の評価ができない場合がある。
(経静脈または経口)造影剤は、臨床的に必要でない場合や、一部の被験者では禁忌である場合がある。造影プロトコールが被験者に適しているかどうかを判断するのは、放射線科医と監督する臨床医である。患者や被験者の最善の利益のために、経静脈的造影を省略したり、投与パラメーターを変更したりする場合がある。その場合に、腫瘍の計測自体は可能であっても、プロファイルには適合しない可能性がある。
造影プロトコールでは、一貫性のある造影相と増強効果を達成することが重要である。ボーラストラッキングは利用可能であれば優れたツールであるが、必須ではない。ボーラストラッキングを使用する場合、トリガーに使用されるROIを配置するための撮影と、撮影のトリガーに使用するしきい値について撮影間で一貫性を保つ必要がある。ボーラストラッキングが利用できない場合は、造影剤量、注入レート、注入後の撮影タイミング、生理食塩水によるフラッシュの有無、について撮影間で一貫性を保たなければならない。経口造影剤の使用の有無は、すべての腹部撮影で一貫している必要がある(ただし、経口造影剤の投与タイミングは経静脈造影剤よりも許容範囲が大きい)。
注:2つの時点で非造影撮影の場合は、造影に関しては一貫していると判断される。
経口造影剤を使用する場合は、使用した造影剤の総量と種類を記録することを推奨する。経静脈造影剤を使用する場合は、造影剤の種類、実際に投与した総量、濃度、注入速度、ディレイ、生理食塩水によるフラッシュの有無を記録することを推奨する。 理想的には、これらの項目は撮影装置によって画像ヘッダーに記録されるのがよい。これは、放射線技師が入力するテキストと造影剤注入装置を組み合わせた自動インターフェースで行われる場合がある。もしくは、フォームに放射線技師がこの情報を手動で入力し、DICOMセカンダリキャプチャ画像として画像データに含めることもできる。
被験者のポジショニング
被験者のポジショニングについて、仰臥位/上肢挙上/足を先に配置するといったことは、一貫性を促進するという利点がある(常に同じにすれば、ベースラインと一貫性があることになる)。また、アーチファクトの原因となる経静脈点滴ルートがガントリー内に存在してしまう症例を減らすことができる。一貫したポジショニングにより、濃度変化、重力による形状および液体分布の変化、姿勢・ゆがみなどによる解剖学的形状の変化などが回避される。被験者のポジショニングの重要な詳細点としては、上肢の位置、背中や膝下に枕をいれることで調整される脊椎の前後方向の曲率、脊椎の左右方向の直線性などである。腹臥位は推奨されない。胸骨は、テーブルの正中線上に配置する必要がある。中腋窩線がガントリーの最も広い部分になるようにテーブルの高さとセンタリングが調整されなければならない。
(乳腺を除いて)胸部をガントリーの中心にポジショニングすることは、肺の全体的なCT値の一貫性を改善させ、スキャンごとの線量調整アルゴリズムの挙動の変動性を減少させる。被験者には楽な姿勢を取ってもらい、モーションアーチファクトの可能性を抑え、うまく息止めが出来るようにする必要がある。
患者が仰臥位の場合、腰椎前弯がまっすぐになり、肩甲骨が両方ともテーブルに接触するように、膝と頭の下にポジショニング用の枕を配置することを推奨する。ただし、枕の正確なサイズ、形状などは、プロファイルの要件に大きな影響を与えないと考えられる。臨床試験や臨床現場ではそれぞれの望ましいポジショニングを決めておくことが期待される。撮影間の一貫性を促進するアプローチが不可欠である。
頭頸部腫瘍を画像化する場合、ガントリーチルトや位置決め補助具を使用して頭頸部のスライスの向きを調整することは珍しくない。繰り返しになるが、時点ごとで妥当な一貫性を達成することが重要である。
被験者の取り扱いの仕様では、患者のポジショニングに直接的には必要条件を設けていないが、2つの時点でのポジショニングが異なる場合、放射線科医がプロファイルからの逸脱と判断することになる。ポジショニングに一貫性を持たせることは、検査の大部分が適合していることを保証し、プロファイルのパフォーマンス目標を達成するのに役立つ。
画像ヘッダーに被験者のポジショニングとテーブルの高さを記録することは、ベースラインの特性を監査し、繰り返すのに役立つ。放射線量を減少させるために使われるビスマス製のブレストシールドも画像のノイズを増加させる。ブレストシールドの画質に対する影響は、シールドの種類やポジショニングによって変化しうる。American Association of Physicists in Medicineでは現在はブレストシールドの使用を推奨しておらず、他の線量低減の方法を推奨している(https://www.aapm.org/publicgeneral/BismuthShielding.pdf)。このようにブレストシールドの使用はこのプロファイルでは推奨されない。もし使用する場合は、ブレストシールドが画像を劣化させないように配置する必要がある。
金属およびその他の高密度材料などのアーチファクト源は、画像を劣化させ、腫瘍の真の境界を特定することが難しくなる可能性がある。撮影ジオメトリによっては、アーチファクト源から離れてアーチファクトが生じることもある。アーチファクトを避ける最も簡単な方法は、可能であれば、撮影時に患者からアーチファクト源を完全に取り除くことである。食道内の残留口腔造影剤によるアーチファクトは、食道付近の小さな腫瘍の計測に影響を与える可能性があるが、ここでは取り扱わない。
患者のセンタリングに一貫性を持たせることで、撮影時の線量調整アルゴリズムの動作のばらつきを回避することができる。
撮影中の被験者への指示
息止めは、画像を劣化させるモーションアーチファクトを減らすことができる。また、最大吸気にすることで、肺を膨らませて内部構造を分離し、腫瘍をより目立たせることができる。
最大吸気に達した最初の数秒で横隔膜が弛緩してモーションが発生する可能性がある。適切な息止めでは「横になる、完全に息を吸う、息を止める、楽にする」などの指示が含まれ、最大吸気を達成してから5秒後に撮影を開始する。
すべての撮影で、一貫性・再現性の高い最大吸気で撮影する努力が必要である。患者が我慢可能なようにライブ音声での息止め指示が強く推奨される。しかし、各現場の判断により、録音した息止め指示でも問題がないこともある。胸壁や腹部の動きを注意深く観察することによって、呼吸が指示通りできているか確認されなければならない。撮影は、最大吸気に達し、全ての動きが止まっていることが確認されるまで始めてはならない。
撮影を行う前に、息止めの練習をすることが強く推奨される。これによって、被験者は息止めに慣れることができ、放射線技師も被験者の呼吸リズムに慣れ、被験者が難しく感じる部分に対処しやすくなる。
息止め指示の例を以下に示す:
- 「息を吸ってください」(前胸壁が上がるのを見る)
- 「息を吐いてください」(前胸壁が下がるのを見る)
- 「では、できるだけ大きく息を吸って、吸って、吸って、吸って…」
- (胸部と腹部の動きが止まったら)「息を止めてください」
- 声帯が閉じてから横隔膜が弛緩するまでの時間を考慮しながら、胸部と腹部が止まっている間に撮影を開始する。
- (撮影が終わったら)「楽にしてください」
3.6.2 仕様
| パラメーター | アクター | 必要条件 |
|---|---|---|
| 造影プロトコール | 放射線科医 | 造影プロトコールを規定し、ベースラインとの一貫性を保つこと(造影剤を使用しないこともありうる) |
| 経静脈造影剤 | 放射線科医 | 選択した造影プロトコールによって十分な腫瘍の強調効果が得られるか判断すること。 |
| 放射線技師 | 規定された造影プロトコールを使用すること。 | |
| 経口造影剤 | 放射線科医 | 選択した造影プロトコールによって十分な腫瘍の強調効果が得られるか判断すること。 |
| 放射線技師 | 規定された造影プロトコールを使用すること。 | |
| アーチファクト源 | 放射線技師 | 再構成された画像の劣化がないように、ブレストシールド、金属を含んだ服、心電図のリードなどのアーチファクトの原因となるような金属製品は、取り除くか、位置を変えること。 |
| テーブルの高さとセンタリング | 放射線技師 | 中腋窩線がガントリーのアイソセンターを通過するように、 テーブルの高さを調整すること。 矢状断方向のレーザーが胸骨に沿って(胸骨上ノッチから剣状突起まで)位置するようにポジショニングすること。 |
| 息止め | 放射線技師 | 被験者が適切な息止めできるように指示する。深吸気になってから、横隔膜が弛緩するまでのタイムラグを考慮して、撮影を開始する。 |
3.7 画像データ取得
このアクティビティは、各時点の画像データ取得に関するものである。このプロファイルの要件を満たすために必要なデータ取得の詳細を記述している。このアクティビティはすべての患者 に適用される。プロトコールデザインのアクティビティ(Section3.5)では、いくつかの同様のパラメーターに触れているが、ここではSection3.5で触れられていない標準プロトコールのデザインやファントムによるパフォーマンスの検証など、各患者での詳細事項について述べる。
3.7.1 考察
腫瘍体積解析のためのCT撮影は、このプロファイルに記載されている仕様に適合する撮影装置で実行できる。ただし、個々の被験者に対して同じメーカーの撮影装置、モデル、バージョンですべての撮影を実行することを強く推奨する。
多くの撮影パラメーターは直接的・間接的に結節の検出・セグメンテーション・計測に影響を与える。これらの変動性の影響を小さくするために、多くの撮影パラメーターは可能な限りベースラインと一貫している必要がある。
撮影プロトコールは、多くの場合、モダリティワークリストで要求された手順に基づいて、撮影時に放射線技師によって選択される。計測がプロファイルに適合するために、使用するプロトコールが特定の必要条件とパフォーマンス指標を満たすか(物理士などによって)検証される必要がある(Section3.5.2を参照)。実施施設において、どのプロトコールが検証済であるかを何らかの方法で放射線技師に伝える必要がある。例えば、プロトコール名に含める、紙のリストにする、モダリティコンソール内に専用のリストをつくる、などが考えられる。放射線技師がどれを選んでもいいように、すべてのプロトコールを検証してもよい。
パラメーターを画像ヘッダーに記録することで、適合性の確認が容易になる。
ローカライザーは、放射線技師がアーチファクト源を見つけて取り除く機会を提供する。
解剖学的領域を完全にカバーするために2回以上の息止めが必要な場合、複数の腫瘍がそれぞれ異なる息止めで撮影されることがある。計測に影響を与える不連続性やギャップを避けるため、一回の息止めでの撮影範囲内に各腫瘍を完全に含める必要がある。
被験者に物理的な変形があったり、外部ハードウェアを配置する必要があったりするため、撮影平面は被験者ごとに異なる場合がある。個々の被験者で、撮影平面に一貫性を持たせることで、腫瘍の見た目が変わってしまうことを防ぐことができる。一部の頭頸部検査を除いて、垂直撮影平面(チルトなし)が望ましい。
3.7.2 仕様
| パラメーター | アクター | 必要条件 | DICOM Tag |
|---|---|---|---|
| 撮影プロトコール | 放射線技師 | このプロファイルのために準備され、検証されたプロトコールを選択すること。 (3.5.2プロトコールデザインを参照のこと)。 |
|
| ローカライザー | 放射線技師 | 体積計測に影響を与えてしまうようなアーチファクト源がないことを確認すること。 | |
| 胸部の撮影時間 | 放射線技師 | 必要な解剖学的構造をカバーするのにテーブル移動が必要な場合は、少なくとも4㎝/秒であること。 | Table Speed (0018,9309) |
3.8 画像再構成
このアクティビティでは、被験者の画像データの再構成について記述されている。撮影したデータから画像を作成することに関連する基準と手順が含まれており、プロファイルの要件を満たすのに必要である。このアクティビティはすべての患者に適用される。プロトコールデザインのアクティビティ(Section3.5)では、いくつかの同様のパラメーターに触れているが、ここではSection3.5で触れられていない標準プロトコールのデザインやファントムによるパフォーマンスの検証など、各患者での詳細事項について述べる。
3.8.1 考察
「このプロファイルのために準備され、検証されたプロトコールを選択すること。」という必要条件については、放射線技師が被験者を撮影する前に毎回ファントムを撮影することを要求するものではない。Section3.5.2で記述されるように放射線技師が使用するプロトコールがその実施施設で検証されることが必要となる。また、プロファイルへの適合性はプロトコールを選択する放射線技師に依存する。
再構成プロトコールは、画像のピクセル特性に影響する。必要な画像特性を達成するためにプロトコールが検証されていれば、互換性があると見なされる。選択したプロトコールと重要な変更を記録・伝達し、QAアクティビティで放射線科医がその情報を利用できるようにする必要がある。プロファイルは記録・伝達の方法は特に規定しない。手作業でもよい。
再構成のField of View(FOV)は通常、各撮影時に選択され、ほとんどの再構成アルゴリズムの画像マトリックスサイズは512×512であるため、再構成された画像のピクセルサイズに影響する。より多くの解剖学的構造を含むようにFOVを拡大する必要がある場合、ピクセルサイズは大きくなり、要件を達成するには不十分になる可能性がある。FOVの小さなターゲット再構成を使用する場合は、同じFOVですべての時点の画像を再構成する必要がある。ピクセルサイズは、対象のX軸・Y軸方向のボクセルサイズに直接影響する。部分容積効果を減らし、高い計測精度を得るためには、ボクセルサイズは小さいほうが望ましい。
各軸方向のピクセルサイズは、それぞれの空間分解能と同じではない。再構成された画像の空間分解能は、再構成関数など多数の要因に依存するが、関数はプロトコールで設定されており、空間分解能への影響はプロトコールデザインアクティビティのf50値の必要条件によって評価される(3.5.2を参照)。
3.8.2 仕様
| パラメーター | アクター | 必要条件 | DICOM Tag |
|---|---|---|---|
| 再構成プロトコール | 放射線技師 | このプロファイルのために準備され、検証されたプロトコールを選択すること。 (3.5.2プロトコールデザインを参照のこと)。 |
|
| 再構成スライス厚 | 放射線技師 | 0.5~2.5mmにすること(もしプロトコールに含まれていない場合)。 | |
| 画像再構成間隔 | 放射線技師 | 再構成画像スライス厚以下であること (ギャップがないこと、オーバーラップはあってもよい)。 ベースラインと一貫性を持たせること。 |
|
| 再構成FOV | 放射線技師 | FOVが少なくとも胸部や腹部全体を含み、かつ大きすぎないことを確認すること。 | Reconstruction Field of View (0018,9317) |
3.9 画像QA(品質保証)
このアクティビティでは、画像解析の前に再構成された画像を評価する。プロファイルの要件を満たすために必要な画像の基準が含まれている。このアクティビティはすべての患者に適用される。被験者の取り扱い(Section3.6)などのアクティビティには、ここで言及する問題を回避するための必要条件が含まれるが、そのアクティビティが成功したかどうかをこのQAステップで確認する必要がある。
3.9.1 考察
この画像QAアクティビティは、画像の生成と解析の間に実行されるQAの部分を表し、画像の特性がプロファイルに適合しているかチェックされる。ここにリストされている画像QAの項目は、プロファイルの要件達成に関連してQIBAが強調するために選択したものである。実施施設では、よりよい画像運用の一環として、他のQA手順も実行することが望ましい。
放射線科医は、このアクティビティの最終的な責任者である。ただし、放射線技師が撮影時に詳細を確認し、患者の体動やアーチファクトなどの問題に対処するために撮影や再構成を繰り返すことがとくに有効である場合がある。
これらのチェックをレポート作成時に放射線科医が行い、放射線技師が撮影時にそういった問題を回避できたかどうかを確認する。その結果、腫瘍計測値の中で、プロファイルのパフォーマンス目標を達成していないものを検出することになる。
患者のポジショニングの変動とは、患者の向きの違い(腹臥位、仰臥位、側臥位など)とポジショニング用枕の使用の有無を指す。患者がある時点では仰臥位で撮影したのに、別の時点では腹臥位で撮影した場合は、重力の方向が変化し、一部の腫瘍が空洞内で変形したり、他の構造によって圧迫されたり、臓器の変形の影響を受けたりすることがある。
撮影平面の変動とは、ガントリーの傾きの違い、または頭/首の位置の違いを指す。体積計測に影響する要因の一部は等方性ではないため、撮影平面に対する腫瘍の向きがある時点と別の時点で変化すると、ばらつきが大きくなる可能性がある。
患者のモーションアーチファクトは、細気管支透亮像の視認性や、肺野条件での肺内構造の境界の明瞭さなど、さまざまな形で現れる。
デンスオブジェクトアーチファクト(患者の内部と外部の両方)は、Section3.6で説明したように腫瘍境界を評価する能力を低下させる可能性があり、体積変化の計測精度と再現性が不十分になる。
臨床状態は、腫瘍の境界を評価する能力を低下させたり、腫瘍自体の構造に影響を与えたりする可能性がある。たとえば、無気肺、胸水、肺炎、気胸などは、結節周囲の肺の構造変化を引き起こす可能性がある。また、壊死により、腫瘍範囲の決定が難しくなる場合もある。
被験者ごとの要因以外のものとして、下記のような腫瘍特性が画質に影響を与える可能性がある。
腫瘍のサイズは、計測の精度に影響を与える可能性がある。理論的にも、QIBAが行った基礎プロジェクトでの検討でも、小さな腫瘍では計測誤差が大きな影響を与えることが示されている。このプロファイルで規定されるサイズより小さい腫瘍については、QIBA Small Noduleグループが作成したプロファイルを参照し、画像化の際の推奨事項と性能の要件を確認すること。腫瘍が非常に大きい場合は、計測において物理的問題よりも解剖学的問題が大きくなる。そのような腫瘍では、解剖学的境界や隣接臓器に浸潤し、セグメンテーションの一貫性を保つのが困難になる可能性がある。
腫瘍境界の明瞭さは、周囲構造から腫瘍の境界を識別できる明瞭さを指す。腫瘍境界の明瞭さ腫瘍範囲を適切にセグメンテーションする性能に直接影響する。腫瘍境界の明瞭さの問題は、不十分なコントラスト、内部のテクスチャ、腫瘍の均一性や構造、腫瘍が他の構造に隣接していることなどに起因する。
2つの時点間で一貫性を保つには、造影についても考慮しなくてはならない。両方の時点での非造影の撮影をした場合は要件を満たす。
腫瘍の計測性は、放射線科医の判断に基本的に委ねられており、2つの時点の計測性や、腫瘍のセグメンテーションの一貫性を監視し、不適合とする責任がある。腫瘍がスライスごとに境界の明瞭さが異なる場合、明瞭さはよいが複雑なジオメトリを持っている場合、ソフトウェアによるセグメンテーションが明らかに失敗している場合、2つの時点で背景部分の造影増強効果が異なっている場合などで、放射線科医はその腫瘍を不適合とする必要がある。逆に、腫瘍が別の構造に付着しているが、放射線科医が2つの時点で一貫したセグメンテーションを得ることができると判断した場合、その腫瘍は適合していると判断される。
腫瘍形状は、仕様のパラメーターとして明示的には規定されない。腫瘍形状だけで必ず不適合と判断されることはない。基礎検討では、複雑な形状の腫瘍(スピキュラを伴う腫瘍など)よりも単純な形状の腫瘍の方が計測の一貫性が保たれることが示されているが、腫瘍の大きさ、腫瘍の境界の明瞭さ、腫瘍の計測性を考慮すれば十分であると考えられる。また、腫瘍径による単純なサイズ評価では複雑な形状の腫瘍を適切に評価することは難しいため、そのような複雑な形状の腫瘍では体積によるサイズ評価の利点が相対的に大きい。
このプロファイルは「病変指向」であることに留意すること。ある腫瘍がこのSectionの仕様に適合しておらず除外された場合、同じ検査での別の腫瘍については両方の時点で仕様に適合するのであれば、その腫瘍は除外されない。さらに、将来の研究の結果、除外された腫瘍が2つの時点で適合していると判断されるようになった場合、その腫瘍についても要件を満たすことになる。
放射線科医は、Section3.9.2画像QAの仕様に対する適合性を確認する責任があるが、監査のためのデータを保存する方法については個々の実施施設の判断に任される。情報を記入するためのQIBAワークシートを使用する、放射線科医が各パラメーターを臨床レポートに記載するといった方法が考えられる。記入する情報の例としては撮影時の体動の有無、デンスオブジェクトアーチファクトの有無、造影増強効果がベースラインと一致しているかどうか、腫瘍の境界の明瞭さ、などがある。
3.9.2 仕様
放射線科医は、計測される各腫瘍について以下の仕様が評価されていることを確認するものとする。
| パラメーター | アクター | 仕様 |
|---|---|---|
| モーションアーチファクト | 放射線科医 | モーションアーチファクトがないことを確認すること。 |
| デンスオブジェクトアーチファクト | 放射線科医 | 濃度の高い物体や解剖学的構造によるアーチファクトがないことを確認すること。 |
| 臨床状態 | 放射線科医 | 腫瘍の計測性に影響を及ぼす臨床状態がないことを確認すること。 |
| 腫瘍サイズ | 放射線科医 | 腫瘍の面内長径が10 mm~100mmであることを確認すること(球状の腫瘍であればおよそ0.5㎝3~524㎝3となる)。 |
| 結節の境界の視認性 | 放射線科医 | 腫瘍の境界が十分に明瞭で、同程度の濃度の他の構造と接触していないことを確認すること。 |
| 造影 | 放射線科医 | 造影検査の場合は、造影増強効果がベースラインと同程度であることを確認すること。 |
| ポジショニングの一貫性 | 放射線科医 | 患者のポジショニングによる腫瘍の変形の程度がベースラインと一致していることを確認すること (例えば、1時点では仰臥位で、別の時点では腹臥位であれば腫瘍の変形の程度が異なる場合がある)。 |
| 息止めの一貫性 | 放射線科医 | 息止めと吸気状態がベースラインと同程度であることを確認すること。 |
| 撮影平面の一貫性 | 放射線科医 | (ガントリー傾斜や頭頚部のポジショニングによる)解剖学的スライス方向がベースラインと一致していること。 |
| 再構成スライス厚 | 放射線科医 | 再構成スライス厚が0.5mm~2.5mmであり、ベースラインと同程度(0.5mm以内)であること。 |
| Field of View (FOV) | 放射線科医 | 撮影と再構成のFOV設定がベースラインと一致していること。 |
| 腫瘍の計測性 | 放射線科医 | 計測の一貫性、accuracyに問題があると考えられる腫瘍を不適合と判断すること。 逆にアーチファクトがあったり、腫瘍が周囲構造に接触したりしていても、セグメンテーションの輪郭を調整してその影響をなくすことができると考えられるのであれば、その腫瘍は不適合と判断する必要はない。 |
3.10 画像解析
このアクティビティは、被験者の1回もしくは複数回の撮影での体積計測に関わるものである。このプロファイルの要件を満たすために必要な画像からの定量的計測に関する基準や手順を記している。
3.10.1 考察
このプロファイルは、各腫瘍について以前の画像セットからの体積変化を評価するものである。
セグメンテーションといわれる腫瘍の境界決定、腫瘍の体積計算、2時点間の腫瘍の体積の差分計算によって体積変化が評価される。このプロファイルでは、同じ画像解析ツールと同じ放射線科医が特定の腫瘍の両方の時点を計測する必要がある。この必要条件は、2つの時点間で画像解析ツールや放射線科医が異なった場合にみられる変動性を考慮している。詳細については、表2-1および関連する考察を参照すること。
腫瘍体積変化の信頼区間(CI)を提示する解析ツールの仕様が推奨される(Section3.2.2を参照)。 95%CIは、次のように解釈される:2つの時点での腫瘍体積変化を繰り返し計測し、各計測で95%CIを構築した場合、そのCIの95%に腫瘍の真の体積値が存在する。
どの腫瘍を計測するかについては、このプロファイルの範疇外である。プロトコールで指定する、正式な治療応答基準で指定する、臨床的な必要性によって決定する、といった場合が考えられる。計測対象の腫瘍は、腫瘍医または臨床研究者、臨床現場の放射線科医、中央読影施設の読影者、自動解析ツールソフトウェアによって指定される。
3.10.2 仕様
| パラメーター | アクター | 仕様 |
|---|---|---|
| 読影パラダイム (Reading Paradigm) |
放射線科医 | 2時点で解析ツールや放射線科医が異なった場合は、解析をやり直すこと。 |
| 結果の検証 | 放射線科医 | ツールによって行われたセグメンテーションの輪郭を確認、承認すること。 |
4. 評価手順
このプロファイルに適合するため、参加するスタッフと機器(「アクター」)は、表3-1で割り当てられた各アクティビティをサポートするものとする。
アクティビティをサポートするために、アクターはSection3のアクティビティの仕様表に記載されている(「言語」で示されている)必要条件のチェックリストに適合するものとする。
Section3で説明されている必要条件のほとんどは、直接観察することで適合性を評価できるが、一部のパフォーマンスに関する必要条件は評価できない。その場合、必要条件はSection4の評価手順subsectionを参照すること。
4.1 評価手順:面内空間分解能
メーカーまたは実施施設は、この手順を使用して、再構成された画像の面内空間分解能を評価する。分解能は、変調伝達関数(MTF)のf50値[mm-1]で評価される。おおまかには、MTFは無限に小さい対象のぼけを表し、f50値は対象のコントラストが50%減少した空間周波数を表し、f50値の逆数は50%劣化する対象のサイズを表す。したがって、f50値が0.4 mm-1の場合、2.5 mm(またはそれ以下)の対象のコントラストは50%(またはそれ以上)低下する。
評価者は、最初に装置のX線管球を温め、メーカーの推奨事項に従ってキャリブレーションスキャン(多くの場合、air-calibration scanと呼ぶ)を実行する。
評価者は、ACRの CT Accreditation Program(CTAP)Phantomのモジュール1やAAPM TG233ファントムなどの空間分解能ファントムを撮影する。AAPM TG233ファントムには、軟部組織相当のHU値の円柱オブジェクトが含まれている。撮影プロトコールと再構成パラメーターは、このプロファイルに適合しなければならない(Section3.5.2、3.7.2、3.8.2を参照)。Section4.1および4.2の評価を実行する場合、同じプロトコールとパラメーターを使用する必要がある。つまり、分解能評価時のノイズレベルは、ノイズ評価時の計測したレベルに対応する必要がある。
ファントムは、ファントムの中心をアイソセンターに合わせて配置し、Z軸に沿って適切に位置合わせする。詳細については、CT Accreditation Testingの手順Section C、Step3を参照すること。
http://www.acraccreditation.org/~/media/ACRAccreditation/Documents/CT/CT-Accreditation-Testing-Instructions.pdf
撮影の後、評価者はAAPM TG233やメーカーの解析ソフトウェアなどを用いて、標的軟部組織相当のオブジェクトのエッジに沿ったXY平面のMTFの平均として計測されるMTF曲線を生成する。次に、評価者は、MTF曲線の0.5 MTFに対応する空間周波数(単位:mm-1)として定義されるf50値を求め、記録する。
評価者は「空気オブジェクト」(つまり、ファントムの空洞カットアウト領域)のエッジを使用してMTF曲線を生成し、f50値を求める。ファントムに、評価のための空洞カットアウト領域がない場合、ファントムの外側のエッジを使用してもよい。
上記の手順は、参考基準となる方法として挙げられている。MTFをFDAに提出するためにメーカーが使用する方法もこの評価手順で容認される。逐次近似法の場合、メーカーはそのアルゴリズムに適した専用のテスト方法を用いる場合があることに注意すること。
代替となる方法を用いる場合は、実施施設はその方法とQIBAが提唱する方法やメーカーによる方法と同等であることの根拠を提出する場合がある。QIBAによりレビュー・承認されれば、その代替方法もこのプロファイルで受け入れられた評価手順となる。
この評価手順は、従来のfiltered back-projection(FBP)でも逐次近似法でも適用できる。
AAPM TG233のファントムとソフトウェアはXY平面のMTFに加えて、Z軸方向の分解能(Z軸方向のMTF)も提供することに注意すること。
4.2 評価手順:ボクセルノイズ
この手順は、メーカーまたは実施施設が再構成画像のボクセルノイズを評価するために使用できる。ボクセルノイズは、均質密度(均一濃度)の物質を画像化した場合のピクセル値の標準偏差で評価される。
評価者は、最初に装置のX線管球を温め、メーカーの推奨事項に従ってキャリブレーションスキャン(多くの場合、air-calibration scanと呼ぶ)を実行する。
評価者は、水と同等の物質からなる直径20 cmの円柱を含むACRの CT Accreditation Program(CTAP)Phantomのモジュール3のような、均質密度のファントムを撮影する。ファントムは撮影装置のアイソセンターに配置する必要がある。撮影プロトコールと再構成パラメーターは、このプロファイルに適合しなければならない(Section3.5.2、3.7.2、3.8.2を参照)。Section4.1および4.2の評価を実行する場合、同じプロトコールとパラメーターを使用するものとする。
撮影後、評価者はファントムの均一部分から中央に近いと思われる代表スライスを一枚選択する。
スライスの中心付近に少なくとも400 mm2の関心領域(ROI)を配置する。評価者は、ROIの平均値と標準偏差を記録する。
評価者は、計測時の画像と計測の詳細を記録することが推奨されるが、上記の2つの値以外は必須ではない。詳細を記録しておくことは、ボクセルノイズが許容限度に近い場合に役立つ。
ここで、ノイズは標準体格サイズのオブジェクトで評価することに注意すること。患者の体格サイズに適応するプロトコール(Automatic Exposure Controlを使用するプロトコールなど)の場合、体格サイズが異なるとノイズ性能がプロファイルに適合しなくなる可能性が考慮されるならば、CT装置のノイズ性能には、(AAPM TG233で提供されるファントムを使用するなどによって)体格サイズの関数としてのノイズを含める必要がある。
上記の手順は、参考基準となる方法として挙げられている。実施施設は、(メーカーのQAファントムの水部分を使用するなど)代替となる方法について、参考基準となる上記の方法やメーカーの方法と同等の結果が出せる根拠をQIBAに提出することができる。QIBAによりレビュー・承認されれば、その代替方法もこのプロファイルで受け入れられた評価手順となる。
この評価手順は、合理的なノイズの制限を設定し、セグメンテーションのパフォーマンス低下を回避するための、単純なファントム計測を目的としている。この評価手順は、従来のfiltered back-projection(FBP)でも逐次近似法でも適用できる。再構成によるノイズ評価において、ノイズテクスチャが異なる場合には、ボクセルノイズは画像ノイズを評価するのに限界があることに注意すること。
4.3 評価手順:腫瘍体積計算のaccuracy
この手順は、メーカーまたは実施施設で、画像解析ツールが腫瘍の体積を正確に計算できるかどうかを評価するために使用できる。accuracyは、体積の真値がわかっている腫瘍をセグメンテーションして体積を計算して、エラー率を評価する。
評価者は、Quantitative Imaging Data Warehouse (QIDW http://qidw.rsna.org/)に移動し、QIDW Data Inventoryを選択し、CT Volumetry Profile Conformance Testingを選択し、LungMan DRO zipファイルをダウンロードして、テストファイルを入手する。
注:評価者は、QIDWデータインベントリへアクセスするために(無料の)ユーザーアカウント登録をしてログインする必要がある。
テストファイルには、1.5 mmのZ軸解像度を持つデジタル参照オブジェクト(「仮想ファントム」)を含んだ11個のDICOM連続画像が含まれている。画像内には球状の「腫瘍」と箱型の「腫瘍」があり、両方とも-10 HUの濃度を持ち、-1000 HUの領域内に配置されている。テストファイルはセグメンテーション後の体積計算のBiasを評価することを意図しているため、ツールによってセグメンテーションを容易に行えるようにしている。
評価者は、画像解析ツールを使用して、テスト画像に存在する球状腫瘍と箱型腫瘍の両方をセグメンテーションし、各腫瘍の体積を計算する。
評価者は、計算された体積値と真値との差の割合(percentage difference)を記録する。
ダウンロードしたzipファイルには、「QIBA Volumetry CT - 4.3 Assessment Procedure Tumor Volume Computation(QIBA Volumetry CT-4.3評価手順:腫瘍体積計算)」という名前のExcelスプレッドシートが入っており、各腫瘍の重心の座標、その体積の真値、結果を記録して性能を評価する統計分析ツールが含まれている。
4.4 評価手順:腫瘍体積の再現性(Repeatability)
この手順は、単一の腫瘍の体積を計測する再現性(Repeatability)を評価するために、メーカーまたは実施施設で使用できる。再現性(Repeatability)は、2つの時点で体積の真値が既知の腫瘍をセグメンテーションして体積計算する際の再現性係数を用いて評価される。この手順では、画像解析ツールと操作する放射線科医を一つのペアのシステムとして評価する。
評価手順には次のステップがある。
- 指定されたテスト画像セットを取得する(Section4.4.1を参照)。
- 2つの時点で指定された腫瘍の体積を計測する(Section4.4.2を参照)。
- パフォーマンスの統計指標を計算する(Section4.4.3を参照)。
標的病変の位置は提供されるため、この手順では腫瘍の検出は評価されない。
4.4.1 テスト画像セットの取得
テスト画像セットは、複数の被験者の肺にある複数の標的腫瘍で構成されている。これはプロファイルの規定範囲を反映している。
評価者は、Quantitative Imaging Data Warehouse(QIDW http://qidw.rsna.org/)に移動し、QIDW Data Inventoryを選択し、CT Volumetry Profile Conformance Testingを選択し、RIDER Lung CT Dataを選択して、RIDER Lung CT Data zipファイル(約4GB)をダウンロードして、テストファイルを入手する。
注:評価者は、QIDWデータインベントリへアクセスするために(無料の)ユーザーアカウント登録をしてログインする必要がある。
テストファイルは31症例あり、1症例につき2つの時点で、それぞれ1つの標的腫瘍をセグメンテーションする。各症例の各時点の画像は、DICOMファイルで提供される。各症例で、さまざまなサイズの複数の結節が撮影されている。標的腫瘍は、X / Y / Z座標で識別される。標的腫瘍と座標のリストは、ダウンロードパッケージの各検査に関連する.csvファイルで提供される。RIDER Lung CT Dataダウンロードパッケージには、「QIBA CTVol TumorVolumeChange Assessment4.4-Repeatability」という名前のExcelスプレッドシートも含まれている。このスプレッドシートにすべての腫瘍の位置がまとめられており、評価者が記録と計算をするのに役立つ。一部の症例では、2つの時点が同じ検査の異なるシリーズにあり、一部の症例では、2つの時点が異なる検査にあることに注意すること。
プロファイルの将来のバージョンでは、より多くの身体領域の腫瘍(縦隔、肝臓、副腎、頸部、後腹膜、骨盤の転移など)をテストデータに含めて、そのような腫瘍にも対応する可能性がある。また、適合するかどうか微妙な境界条件のテストデータを含めることで、最大許容スライス厚、最大許容ノイズなどの条件をさらに検討する可能性がある。
標的腫瘍は、(プロファイル上の定義で)計測可能なものが選択されており、このプロファイルでカバーする範囲での代表的な体積、形状、タイプのものが含まれている。
テスト画像セットは、このプロファイルの必要条件(被験者の取り扱い、撮影プロトコール、再構成など)に従って取得されている。
このテストファイルを使用してアルゴリズムが開発されている場合、評価者によってそのことが報告されなければならない。(開発に使用した)トレーニングデータを使用してテストすることは望ましくないが、より多くのデータセットが利用可能になるまで、避けられない可能性がある。
4.4.2 体積決定
DICOMファイルを解析ソフトウェアにインポートする。評価者は、画像解析アクティビティ(Section3.10参照)で説明されているように、各時点で各標的腫瘍をセグメンテーションしなければならない。評価者は、ツールの通常の操作の一部として、腫瘍のセグメンテーションやシードポイントの編集ができる。(結節全体がセグメンテーションされ、隣接する組織が除外されるように)編集が行われた場合、結果は編集ありと編集なしの両方で報告されなければならない。
画像解析ツールを評価する場合、この評価手順全体で単一の解析者が解析を行う必要がある。
放射線科医を評価する場合、この評価手順全体で単一の画像解析ツールを使用するものとする。
注:テストファイルの31症例のうち11症例は、プロファイルで指定されるイメージQAの基準を満たしていない(Section3.9.2参照)。これらの症例は、QIBAスプレッドシートの[結果]ページで「除外」としてマークされ、パフォーマンス指標の計算には含まれない。評価者は、これらの症例の計測をスキップできる。
評価者は、各標的腫瘍の体積(Y)を計算する。i番目の標的腫瘍について、時点1の体積をYi1と、時点2の体積をYi2とする。
評価者は、各標的腫瘍の体積変化%(d)を次のように計算する。
di=ln(Yi2)-ln(Yi1)
ダウンロードしたQIBAスプレッドシートを使用して、体積計測値を記録し、上記の計算と統計指標の計算を実行する。各症例にかかった時間、コメント、問題点などを記録することは評価には必要ないが、QIBAバイオマーカー委員会への貴重なフィードバックとなる。
4.4.3 パフォーマンスの統計的指標の計算
評価者は、N=20として、下記のように被験者内変動係数(wCV)を計算する。
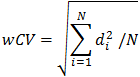
評価者は、再現性係数(RC)を次のように推定する。
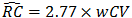
評価者は、標的腫瘍を小腫瘍サブグループ(体積計測値が小さい14個の標的腫瘍が含まれる、スプレッドシートでタグ付けされている)と大腫瘍サブグループ(体積計測値が大きい6個の腫瘍が含まれる、スプレッドシートでタグ付けされている)に分割する。 評価者は両方のサブグループで上記の計算を繰り返して、それぞれのサブグループの再現性係数を推定する。
評価者は、記録の一部として、体積計測値のBland-Altman plotも行うことが推奨される。
4.5 評価手順: 腫瘍体積のBiasと線形性
この手順は、メーカーまたは実施施設が、単一の腫瘍の体積を計測する際のBiasと線形性を評価するために使用できる。Biasは、体積の真値が既知の腫瘍をセグメンテーションして計算するときに、% Biasの観点から評価される。線形性は、体積データに適合する最小二乗回帰(ordinary least squares: OLS) の勾配で評価される。
4.5.1 テスト画像セットの取得
テスト画像セットは、擬人化ファントム(「Lungman」)にさまざまな形状とサイズの複数の標的合成腫瘍をつけたものを、2つの異なる撮影装置で撮影した画像で構成されている。
評価者は、Quantitative Imaging Data Warehouse(QIDW http://qidw.rsna.org/)に移動し、QIDW Data Inventoryを選択し、CT Volumetry Profile Conformance Testingを選択し、QIBA Lung Collection zipファイル(約1GB)をダウンロードし、テストファイルを入手する。
注:評価者は、QIDWデータインベントリへアクセスするために(無料の)ユーザーアカウント登録をしてログインする必要がある。
テスト画像セットは、異なるベンダーの2つの撮影装置を使用したFDA Lungman N1ファントムの撮影で構成されている。サイズ、形状、直径の異なる組み合わせ(Table 4.5.1-1を参照)を持つ7つの合成腫瘍のセットを使用して撮影されている。撮影は3回繰り返され、それぞれがDICOMファイルのセットになっている。各撮影の標的腫瘍と重心座標のリストは、QIBA Lung Collectionダウンロードパッケージの「QIBA Volumetry CT - 4.5 Tumor volume bias and linearity」という名前のExcelスプレッドシートで提供されている。また、スプレッドシートは、評価者がこの評価手順の後半で必要となる記録と計算を行うのに役立つ。画像内には、csvファイルに記載されていない追加の腫瘍が含まれていることに注意すること。Section4.5.2および4.5.3で説明されている結果や計算に、上記の追加の腫瘍の計測値を含めないこと。
Table 4.5.1-1: 標的腫瘍ファントムの特性
| 形状 | 直径 | 濃度 |
|---|---|---|
| 球形 | 10 mm 20 mm 40 mm |
+100 HU |
| 卵型 | 10 mm 20 mm |
+100 HU |
| 分葉状 | 10 mm 20 mm |
+100 HU |
標的腫瘍は、(プロファイル上の定義で)計測可能なように配置されており、プロファイルの範囲を代表するさまざまな体積と形状を持っている。
テスト画像セットは、このプロファイルの必要条件(被験者の取り扱い、撮影プロトコール、再構成など)に従って撮影されている。 Table4.5.1-2を参照のこと。
Table 4.5.1-2: テスト画像セットの撮影および再構成パラメーター
| 撮影装置 | パラメーター | |
|---|---|---|
| Philips 16 (Mx8000 IDT) | KVp: | 120 |
| Pitch: | 1.2 | |
| Collimation: | 16x1.5 | |
| Exposure: | 100 mAs | |
| Slice Thickness: | 2 mm | |
| Increment: | 1 mm | |
| Filter: | Medium | |
| Repeat Scans: | 3 | |
| Siemens 64 | KVp: | 120 |
| Pitch: | 1.2 | |
| Collimation: | 64x0.6 | |
| Exposure: | 100 mAs | |
| Slice Thickness: | 1.5 mm | |
| Increment: | 1.5 mm | |
| Filter: | Medium | |
| Repeat Scans: | 3 | |
4.5.2 体積の決定
評価者は、撮影ごとにDICOMファイルを解析ソフトウェアにインポートし、画像解析アクティビティ(Section3.10を参照)で説明されているように、スプレッドシートで指定された腫瘍をセグメンテーションする。合計で、評価者は39の標的腫瘍のセグメンテーションを実行する(装置1で7腫瘍、装置2で6腫瘍、それぞれ3回撮影)。
評価者は、ツールの通常の操作の一部として、腫瘍のセグメンテーションやシードポイントの編集ができる。(結節全体がセグメンテーションされ、隣接する組織が除外されるように)編集が行われた場合、結果は編集ありと編集なしの両方で報告されなければならない。
画像解析ツールを評価する場合、この評価手順全体で単一の解析者が解析を行う必要がある。
放射線科医を評価する場合、この評価手順全体で単一の画像解析ツールを使用するものとする。
評価者は、各標的腫瘍の体積(Yi)を計算する。ここでiはi番目の標的腫瘍を指す。
ダウンロードしたQIBAスプレッドシートを使用して、体積計測値を記録し、上記の計算を実行する。各症例にかかった時間、コメント、問題点などを記録することは評価には必要ないが、QIBAバイオマーカー委員会への貴重なフィードバックとなる。
4.5.3パフォーマンスの統計指標を計算する
各標的腫瘍の体積の真値(Xi)の自然対数は既知であり、データセットで提供される。
評価者は、各標的腫瘍の計測値の個々の%Bias(bi)を次のように計算する。
bi=lnYi-lnXi
評価者は、N個の標的腫瘍に対する母集団の偏りを次のように推定する。
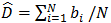
評価者は、%Biasを次のように推定する。
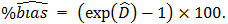
評価者は、母集団Biasの95%信頼区間を次のように推定する。
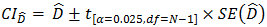
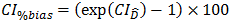
Biasの仕様との比較に使用される全体%Bias(Overall %Bias)を次のように推定する。
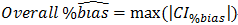
評価者は体積データ log Yiを [ln Xi,(ln X i)2] に適合させるモデルを構築し、2次項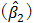 を推定する。
を推定する。
評価者はln Yiをln Xi に適合させる最小二乗回帰を行い、勾配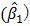 を推定する。
を推定する。
評価者は、標的腫瘍を3つのサブグループ(球状、卵形、分葉状)に分ける。評価者は、各サブグループで計算を繰り返して、球状、卵形、分葉状のサブグループの%Biasを推定する。
評価者は、記録の一部として、ln Yiとln Xiの体積推定およびOLS回帰曲線のplotをすることが推奨される。
4.6 評価手順:実施施設のパフォーマンス
注:現段階でのプロファイルでは、実施施設の全体的なパフォーマンス必要条件はない。
将来のQIBAプロファイルの要件確認段階では、実施施設の全体的なパフォーマンス評価と、プロファイル要件に記載されたパフォーマンスの達成の確認が含まれる予定である。このセクションの手順は、その時点で使用されることが予想されるプロセスの概要であり、将来のバージョンで詳細が述べられる。
この手順では、実施施設で使用され、実施施設のすべてのアクターとアクティビティの総合的なパフォーマンスを評価できる。
評価手順には次のステップがある。
- 撮影の検証(Section4.6.1参照)。
- テスト画像セットの生成(Section4.6.2参照)。
- 腫瘍体積変化の変動性の評価(上記のSection4.4.2、4.4.3参照)。
手順は、実施施設のアクターがこの文書のSection3で説明されている必要条件を満たしていることを前提としている。それらのアクターがQIBA適合性ステートメントを公開しているかどうかは前提条件ではない(ただし、それは有用であり励みになる)。
4.6.1 撮影の検証
Section3.6に準拠するための被験者の取り扱い手順を確認する。
Section3.5に準拠した装置で撮影プロトコールと再構成設定を確立する。装置のメーカーからQIBA適合性ステートメントが入手できる場合、この手順に役立つパラメーターが提供される場合がある。
20cmの水ファントムを撮影し、画像再構成して、Section3.5.2のパフォーマンス必要条件を確認する。
4.6.2 テスト画像セット
Section3.5で確立およびテストされたプロトコールを使用して、テスト画像セットを実施施設で撮影する。
テスト画像セットはSection3.9で説明された特性について適合していなければならない。
考察: 現場では様々な制約があるため、個々の実施施設で得られたテスト画像セットは、QIBAが準備したテスト画像セットよりも包括的でない可能性が高くなる。どのようなテスト画像セットが、制約の中でも有用であるか検討すること。
Appendices
Appendix A:謝辞と帰属
この文書は、Radiological Society of North America (RSNA) Quantitative Imaging Biomarker Alliance (QIBA) Volumetric Computed Tomography (CTVol) Biomarker Comitteeによって提供されている。このComitteeは、学界、専門学会、画像装置メーカー、画像解析ツールソフトウェア開発者、画像解析研究所、医薬品企業、政府研究機関、専門学会、規制当局などで構成されている。すべての作業は、競争前基礎的共同作業によるものである。
Comitteeとその作業の詳細については、下記のWebリンクを参照されたい。
http://qibawiki.rsna.org/index.php?title=Committees.
Profile Editor: Kevin O'Donnell, MASc., Canon Medical Research USA, Inc.
QIBA CT Volumetry Biomarker Committee Profile Co-Authors:
| Samuel G. Armato III, PhD | The University of Chicago |
| Rick Avila | Accumetra |
| Hubert Beaumont, PhD | MEDIAN Technologies |
| Andrew J. Buckler, MS | Elucid Bioimaging, Inc. |
| David Clunie, MBBS | PixelMed |
| Vadivel Devaraju, MS, PhD | The University of Mississippi Medical Center |
| Paul R. Garrett, MD | Smith Consulting, LLC |
| Marios A. Gavrielides, PhD | U.S. Food and Drug Administration (FDA) |
| Ritu Gill, MD, MPH | Brigham and women's hospital |
| Gregory Goldmacher, MD, PhD, MBA | Merck & Co. |
| Lubomir Hadjiiski, PhD | University of Michigan |
| Rudresh Jarecha, MBBS, DMRE, DNB | PAREXEL Informatics |
| Grace Hyun Kim, PhD | University of California, Los Angeles (UCLA) |
| Claudia Kirsch, MD | Northwell Health |
| Qin Li, PhD | U.S. Food and Drug Administration (FDA) |
| Michael McNitt-Gray, PhD | Dept. of Radiological Sciences, David Geffen School of Medicine at UCLA |
| James L. Mulshine, MD | Rush University |
| Reginald F. Munden, MD, DMD, MBA | Houston Methodist Hospital and Research Institute |
| Nancy A. Obuchowski, PhD | Cleveland Clinic Foundation |
| Kevin O’Donnell, MASc | Canon Medical Research USA, Inc. |
| Nicholas Petrick, PhD | U.S. Food and Drug Administration (FDA) |
| Marthony Robins, PhD | Duke University |
| Ehsan Samei, PhD | Duke University |
| Jenifer Siegelman, MD, MPH | Harvard Medical School Brigham and Women's Hospital |
| Daniel C. Sullivan, MD | Duke University |
| Ying Tang, PhD | CCS Associates, Inc. |
| Pierre Tervé, MS | Keosys |
| Amit Vasanji, PhD | ImageIQ |
| Binsheng Zhao, D.Sc. | Columbia University |
QIBA CT Volumetry Biomarker Committee Profile Contributors:
| Maria Athelogou, PhD | DEFINIENS AG |
| Kristin Borradaile, MS | BioClinica, Inc. |
| Patricia Cole, PhD, MD | Takeda Pharmaceuticals |
| Heang-Ping Chan, PhD | University of Michigan |
| James Conklin, MS, MD | ICON Medical Imaging (retired) |
| Gary Dorfman, MD | Weill Cornell Medical College |
| Edward A. Eikman, MD | Moffitt Cancer Center & Research Institute at University of South Florida |
| Charles Fenimore, PhD | Image-Quality Measurement Consultancy |
| Robert Ford, MD | Clinical Trials Imaging Consulting, LLC |
| Matthew Fuld, PhD | Siemens Medical Solutions USA, Inc. |
| Kavita Garg, MD | University of Colorado |
| Ronald Gottlieb, MD, MPH | University of Arizona |
| Dave Gustafson, PhD | Perfint Healthcare |
| Wendy Hayes, DO | Bristol Myers Squibb |
| Bruce Hillman, MD | University of Virginia Health System |
| Philip Judy, PhD | Brigham and Women’s Hospital (semi-retired) |
| Gerhard Kohl, PhD | Siemens AG |
| Oliver Lehner | Definiens AG |
| John Lu, PhD | National Institute of Standards & Technology |
| P. David Mozley, MD | Endocyte Inc. |
| Daniel Nicholson | Definiens AG |
| J. Michael O'Neal, MD | BioClinica Inc. |
| Eric S. Perlman, MD | Perlman Advisory Group, LLC |
| Aria Pezeshk, PhD | U.S. Food and Drug Administration (FDA) |
| Anthony Reeves, PhD | Cornell University |
| Samuel Richard, PhD | Duke University |
| Yuanxin Rong MD, MPH | PAREXEL International |
| Berkman Sahiner, PhD | U.S. Food and Drug Administration (FDA) |
| Ganesh Saiprasad, PhD | Medtronic |
| Lawrence Schwartz, MD | New York Presbyterian Hospital/Columbia University Medical Center |
| Eliot Siegel, MD | University of Maryland |
| Michael D. Silver, PhD | Toshiba Medical Research Institute – USA |
| Neil Steinmetz, MD, JD | Translational Sciences Corporation |
| Matthias Thorn, PhD | Siemens AG |
| David Vining, MD | MD Anderson Cancer Center |
| David Yankelevitz, MD | Mt. Sinai School of Medicine |
| Hiro Yoshida, PhD | Harvard - Massachusetts General Hospital |
| Lifeng Yu, PhD | Mayo Clinic Rochester |
| Luduan Zhang, PhD | LZ Biomedical |
このVolumetric CT Technical ComitteeはRadiological Society of North Americaのスタッフの支援と技術的サポートに深く感謝する。
Appendix B: 用語と定義
撮影(Acquisition)、解析(Analyze)、解釈(Interpretation):この文書では、データを情報(information)から知識(knowledge)にするパイプラインのステップとして、撮影、再構成、後処理、解析、解釈という言葉を整理して用いている。撮影、再構成、後処理は、被験者からの新しいデータを収集し構成するためのものである。解析は、データを情報(information)に変換し、重要な値を抽出する計算ステップである。解釈は、情報(information)を知識(knowledge)に変換する判断である(知識(knowledge)から知恵(wisdom)への変換は、この文書の範疇外である)。
画像解析、画像レビュー、読影:腫瘍治療反応性基準などの画像計測値の生成に至る手順とプロセスである。画像レビューは適合性、安全性、有効性のために行われる。画像レビューパラダイムは、背景に応じた固有のもので、他のパラメーターの中でも特に、臨床試験の具体的な目的、動作中の画像技術、薬剤開発の段階に依存する場合がある。
画像ヘッダー:ピクセルデータ以外の画像ファイル(または画像を含むデータセット)の部分。
画像ファントム:定期的なテストと撮影の標準化に使用されるデバイス。このテストは、実施施設固有および装置固有であり、臨床試験開始前(ベースライン)、試験中、試験終了時に定期的に実施する必要がある。
時点(Time Point):臨床試験において、画像検査または臨床検査が予定されているときの、経過中のある期間のこと。
腫瘍領域決定における変動性:画像内の腫瘍境界の明瞭さのことである。腫瘍の生物学的特性、画像処理の技術的特性、そしてオペレーターの認識、専門知識、教育に依存する。
技術的な変動性:不明瞭さのないオブジェクトを描画する性能のみに起因する。言い換えれば、「技術的な」変動性を評価する際には、計測に用いられる腫瘍は、その領域が明確で、どのオペレーターでも同様に認識されるようなものである必要がある。
再現性(Repeatability):同じ条件(同じ装置、パラメーター、読影者、アルゴリズムなど)で異なる対象に対して行われた複数の計測における再現性。
再現性(Reproducibility):1つ以上の条件が変更された場合に行われた複数の計測における再現性。
Appendix C: 適合性チェックリスト
QIBAチェックリスト: 進行腫瘍におけるCT体積変化計測(CT Tumor Volume Change for Advanced Disease: CTV-AD)
インストラクション
このチェックリストは、「アクター」ごとに整理されている。 アクター(たとえば、解析ツールソフトウェア)に対してQIBA適合性ステートメントが既に利用可能な場合、アクターチェックリストの各必要条件を各自で確認するのではなく、そのステートメントを利用してもよい。
アクターチェックリスト内で、必要条件はQIBAプロファイル文書の対応するアクティビティによってグループ化されている。必要条件の詳細については、対応するアクティビティの考察部分を参照されたい。
適合(Y/N)は、必要条件を満たして適合しているかどうかを示す。 Nとした場合は、その理由を説明すること。
いくつかの必要条件では、特定の評価手順の使用が義務付けられている。プロファイル文書を参照する手間を最小限に抑えるために、そのような評価手順も最後に含まれている。
プロファイルおよび関連するプロセスのすべての面に関するフィードバックは歓迎される。
実施施設チェックリスト
チェックされた実施施設:
| パラメーター | 適合性 (Y/N) |
必要条件 |
|---|---|---|
| 実施施設適合性(Section 3.1) | ||
| 撮影装置 | 使用する全ての撮影装置がプロファイルに適合していることを確認する。 | |
| 再構成ソフトウェア | 使用する全ての再構成ソフトウェアがプロファイルに適合していることを確認する。 | |
| 画像解析ツール | 使用する全ての画像解析ツールがプロファイルに適合していることを確認する。 | |
| 放射線科医 | 関与する全ての放射線科医がプロファイルに適合していることを確認する。 | |
| 物理士 | 関与する全ての物理士がプロファイルに適合していることを確認する。 | |
| 放射線技師 | 関与する全ての放射線技師がプロファイルに適合していることを確認する。 | |
撮影装置・再構成ソフトウェア チェックリスト
チェックされた撮影装置(メーカー/モデル/バージョン):
| パラメーター | 適合性 (Y/N) |
必要条件 |
|---|---|---|
| 製品適合性(Section 3.2) | ||
| 撮影プロトコール | (メーカーや実施施設でデザインと検証がなされた)プロトコールを作成し、放射線技師が撮影時に利用可能であること。 | |
| Section3.5.2プロトコールデザイン仕様書に適合するプロトコールを準備できること。 | ||
| そのプロトコールで、空気と軟部組織のエッジにおけるf50の値が0.3mm-1~0.5mm-1の間の値であること。 4.1 評価手順:面内空間分解能を参照。 |
||
| そのプロトコールでボクセルノイズが標準偏差<60HUであること。 4.2評価手順:ボクセルノイズを参照。 |
||
| 再構成プロトコール | Section3.5.2プロトコールデザイン仕様書に適合するプロトコールを準備できること。 | |
画像解析ツールチェックリスト
チェックされた画像解析ツール(メーカー/モデル/バージョン):
| パラメーター | 適合性 (Y/N) |
必要条件 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 製品適合性(Section 3.2) | ||||||||||
| 多発腫瘍 | 多発腫瘍の計測が可能であること。 | |||||||||
| 多発腫瘍 | 計測された各腫瘍を複数の時点で相関させることができること、もしくは放射線科医がそれらを明確に認識できるようにすること。 | |||||||||
| 読影パラダイム (Reading Paradigm) |
比較のために二つの時点の画像を並べて表示できること。 | |||||||||
| 読影パラダイム (Reading Paradigm) |
最初の時点を再計測できること(たとえば、別の画像解析ツールまたは放射線科医によって計測された場合などのため)。 | |||||||||
| 腫瘍体積計算 | 真の体積の5%以内を計算できること。 Section 4.3評価手順:腫瘍体積計算を参照。 |
|||||||||
| 腫瘍体積再現性 (Repeatability) |
以下のように腫瘍体積の再現性を達成すること:
|
|||||||||
| 腫瘍体積のBiasと線形性 | 以下を達成すること:
Section4.5評価手順:腫瘍体積のBiasと線形性を参照。 |
|||||||||
| 結果の信頼区間 | 下記の式に基づいて、腫瘍体積変化の95%信頼区間を計算し、利用できるようにすることが推奨される。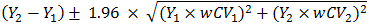 ここで、Y1およびY2は、時点1および2での体積計測結果である。wCV1およびwCV2は、下表で得られるY1とY2の結節内変動係数である。D1、D2は時点1と時点2での面内長径である。
|
|||||||||
Table 3.2.2-1: 全体の再現性係数に基づいた許容される腫瘍体積%Bias
全体の再現性係数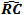 |
許容される全体%Bias (RMSE Target: 7.1%) |
許容されるサブグループ %Bias (RMSE Target: 7.8%) |
|---|---|---|
| 0.05 | 6.60% | 7.32% |
| 0.06 | 6.37% | 7.11% |
| 0.07 | 6.09% | 6.86% |
| 0.08 | 5.75% | 6.56% |
| 0.09 | 5.35% | 6.20% |
| 0.10 | 4.88% | 5.79% |
| 0.11 | 4.30% | 5.31% |
| 0.12 | 3.59% | 4.75% |
| 0.13 | 2.63% | 4.06% |
| 0.14 | 0.84% | 3.17% |
| 0.15 | 0.00% | 1.84% |
| 0.155 | 0.00% | 0.00% |
| 0.16 | n/a (再現性なし) | n/a (再現性なし) |
放射線科医チェックリスト
注:装置ベンダーが提供するプロトコールを使用する場合があるが、放射線科医がプロトコールパラメーターの責任を負う。また、放射線科医はプロトコールが検証されたことを確認する責任があるが、検証の実施については物理士のアクターに責任がある。 プロトコールデザインは、物理士と放射線科医の共同で行われ、放射線科医が最終的な責任を負う。 一部のパラメーターはシステムに依存しており、物理士の特別な注意が必要な場合がある。
チェックされた放射線科医:
| パラメーター | 適合性 (Y/N) |
必要条件 | |
|---|---|---|---|
| スタッフの質的評価(Section 3.3) | |||
| 腫瘍体積変化の再現性 (Repeatability) |
計測の際に画像解析ツールでオペレーターの操作が必要な場合、下記の腫瘍体積変化の再現性を達成すること:
|
||
| プロトコールデザイン(Section 3.5) | |||
| 撮影プロトコール | このTableの仕様を満たすプロトコールを準備すること。 | ||
| 撮影プロトコール | 放射線技師がこのプロファイルの必要条件にある訓練を受けたことを確認すること。 | ||
| Total Collimation Width | 16mm以上であること | Total Collimation Width (0018,9307) | |
| ピッチ (IEC Pitch) |
1.5より小さいこと | Spiral Pitch Factor (0018,9311) | |
| Nominal Tomographic Section Thickness (T) | 1.5mm以下であること。 | Single Collimation Width (0018,9306) | |
| 胸部の撮影時間 | 必要な解剖学的構造をカバーするのにテーブル移動が必要な場合は、少なくとも4㎝/秒であること。 | Table Speed (0018,9309) | |
| 再構成プロトコール | このTableの仕様を満たすプロトコールを準備すること。 | ||
| 再構成プロトコール | 放射線技師がこのプロファイルの必要条件にある訓練を受けたことを確認すること。 | ||
| 再構成スライス厚 | 0.5~2.5mmにすること。 | Slice Thickness (0018,0050) | |
| 画像再構成間隔 | 再構成画像スライス厚以下であること (ギャップがないこと、オーバーラップはあってもよい)。 | Spacing Between Slices (0018,0088) | |
| 被験者の取り扱い(Section3.6) | |||
| 造影プロトコール | 造影プロトコールを規定し、ベースラインとの一貫性を保つこと(造影剤を使用しないこともありうる) | ||
| 経静脈造影剤 | 選択した造影プロトコールによって十分な腫瘍の強調効果が得られるか判断すること。 | ||
| 経口造影剤 | 選択した造影プロトコールによって十分な腫瘍の強調効果が得られるか判断すること。 | ||
| 画像QA(Section3.9) | |||
| モーションアーチファクト | モーションアーチファクトがないことを確認すること。 | ||
| デンスオブジェクトアーチファクト | 濃度の高い物体や解剖学的構造によるアーチファクトがないことを確認すること。 | ||
| 臨床状態 | 腫瘍の計測性に影響を及ぼす臨床状態がないことを確認すること。 | ||
| 腫瘍サイズ | 腫瘍の面内長径が10 mm~100mmであることを確認すること(球状の腫瘍であればおよそ0.5㎝3~524㎝3となる)。 | ||
| 結節の境界の視認性 | 腫瘍の境界が十分に明瞭で、同程度の濃度の他の構造と接触していないことを確認すること。 | ||
| 造影 | 造影検査の場合は、造影増強効果がベースラインと同程度であることを確認すること。 | ||
| ポジショニングの一貫性 | 患者のポジショニングによる腫瘍の変形程度がベースラインと一致していることを確認すること (例えば、1時点では仰臥位で、別の時点では腹臥位であれば腫瘍の変形の程度が異なる場合がある)。 |
||
| 息止めの一貫性 | 息止めと吸気状態がベースラインと同程度であることを確認すること。 | ||
| 撮影平面の一貫性 | (ガントリー傾斜や頭頚部のポジショニングによる)解剖学的スライス方向がベースラインと一致していること。 | ||
| 再構成スライス厚 | 再構成スライス厚が0.5mm~2.5mmであり、ベースラインと同程度(0.5mm以内)であること。 | ||
| Field of View (FOV) | 撮影と再構成のFOV設定がベースラインと一致していること。 | ||
| 腫瘍の計測性 | 計測の一貫性、accuracyに問題があると考えられる腫瘍を不適合と判断すること。 逆にアーチファクトがあったり、腫瘍が周囲構造に接触したりしていても、セグメンテーションの輪郭を調整してその影響をなくすことができると考えられるのであれば、その腫瘍は不適合と判断する必要はない。 |
||
| 画像解析(Section3.10) | |||
| 読影パラダイム (Reading Paradigm) |
2時点で解析ツールや放射線科医が異なった場合は、解析をやり直すこと。 | ||
| 結果の検証 | ツールによって行われたセグメンテーションの輪郭を確認、承認すること。 | ||
物理士チェックリスト
注:物理士アクターの役割は、検証を行う資格のある施設内の物理士、請負業者やベンダーのサービスエンジニアなどが行う。
チェックされた物理士:
| パラメーター | 適合性 (Y/N) |
必要条件 |
|---|---|---|
| 定期的QA(Section 3.4) | ||
| 品質管理(QC) | メーカーの推奨に従って、関連する品質管理手順を実行すること。 | |
| 品質管理(QC) | 監査時のために品質管理手順の日付/時刻を記録すること。 | |
| 面内空間分解能 | 空気と軟部組織の領域においてf50値が0.3~0.5mm-1であること。 Section4.1評価手順:面内空間分解能を参照のこと。 |
|
| ボクセルノイズ | 標準偏差<60HUを達成すること。 Section4.2評価手順:ボクセルノイズを参照のこと。 |
|
放射線技師チェックリスト
チェックされた放射線技師:
| パラメーター | 適合性 (Y/N) |
必要条件 | |
|---|---|---|---|
| 被験者の取り扱い(Section 3.6) | |||
| 経静脈造影剤 | 規定された造影プロトコールを使用すること。 | ||
| 経口造影剤 | 規定された造影プロトコールを使用すること。 | ||
| アーチファクト源 | 再構成された画像の劣化がないように、ブレストシールド、金属を含んだ服、心電図のリードなどのアーチファクトの原因となるような金属製品は、取り除くか、位置を変えること。 | ||
| テーブルの高さとセンタリング | 中腋窩線がガントリーのアイソセンターを通過するように、 テーブルの高さを調整すること。 | ||
| テーブルの高さとセンタリング | 矢状断方向のレーザーが胸骨に沿って(胸骨上ノッチから剣状突起まで)位置するようにポジショニングすること。 | ||
| 息止め | 被験者が適切な息止めできるように指示する。深吸気になってから、横隔膜が弛緩するまでのタイムラグを考慮して、撮影を開始する。 | ||
| 画像データ撮影(Section 3.7) | |||
| 撮影プロトコール | このプロファイルのために準備され、検証されたプロトコールを選択すること。 (3.5.2プロトコールデザインを参照のこと)。 |
||
| ローカライザー | 体積計測に影響を与えてしまうようなアーチファクト源がないことを確認すること。 | ||
| 胸部の撮影時間 | 必要な解剖学的構造をカバーするのにテーブル移動が必要な場合は、少なくとも4㎝/秒であること。 | Table Speed (0018,9309) |
|
| 画像データ再構成(Section3.8) | |||
| 再構成プロトコール | このプロファイルのために準備され、検証されたプロトコールを選択すること。 (3.5.2プロトコールデザインを参照のこと)。 |
||
| 再構成スライス厚 | 0.5~2.5mmにすること(もしプロトコールに含まれていない場合)。 | ||
| 画像再構成間隔 | 再構成画像スライス厚以下であること (ギャップがないこと、オーバーラップはあってもよい)。 ベースラインと一貫性を持たせること。 |
||
| 再構成FOV | FOVが少なくとも胸部や腹部全体を含み、かつ大きすぎないことを確認すること。 | Reconstruction Field of View (0018,9317) | |
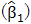 が0.98~1.02の値であること
が0.98~1.02の値であること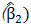 が-0.05〜0.05の値であること
が-0.05〜0.05の値であること