Japan Quantitative Imaging Biomarker Alliance (J-QIBA)
Quantitative Imaging Biomarker
fMRI
QIBA プロファイル:
治療前評価のツールとしてのBlood Oxygenation Level Dependent (BOLD) Functional MRIを用いた運動感覚野のマッピング
Version 1.0 rev1
Stage A: Initial Draft
- 日本語訳作成:
- 鹿児島大学大学院 放射線診断治療学分野 吉浦 敬
- 自然科学研究機構 生理学研究所 福永 雅喜
2019.3.31
目次
未解決の問題
解決済みの問題
1.エグゼクティブサマリー
2.臨床的背景と要件
3.プロファイルアクティビティ
3.1. 開始前
3.2. 設備導入
3.3. 定期的なQA
3.4. 被験者の選択
3.5. 被験者の取り扱い
3.6. 画像データ取得
3.7. 画像QAチェック
3.8. 画像データ処理
3.9. 画像解析:重みづけ重心バイオマーカの計算
3.10. 画像解釈と配信
4. 評価手続き
4.1. 評価手続き:MRI装置の仕様と性能
4.2. 評価手続き:技師
4.3. 評価手続き:放射線科医
4.4. 評価手続き:画像アナリスト/Physicist/研究者
4.5. 評価手続き:画像処理および解析ソフトウエア
参考文献
Appendix
Appendix A:謝辞と帰属
Appendix B:コンベンションと定義
Appendix C:パラダイムの仕様-手運動課題
Appendix D:要件に適合するための撮影装置のパラメータ
Appendix E:fMRIの処理
Appendix F:賦活ボクセル同定のための閾値基準の選択
Appendix G:重みづけ重心の推定とその精度(変動性)
Appendix H:fMRIの変動の原因としての頭部の動き
未解決の問題:
関連する議論を喚起し、読者の注意をフィードバックが必要なトピックに集中させ、最終的な解決に導くまで追跡できるよう、以下に未解決問題を示す。特にパブリックコメントステージの間、これらの問題に関する意見が強く勧められる。
Q. 賦活域の範囲や辺縁を特定することは重要か?
Q. 最適な閾値設定―賦活域を正確に決定するのに最適な閾値は?
Q. データの定量解析における神経血管脱共役の評価について。このプロファイルで述べられている手運動領域以外の部位に神経血管脱共役が存在するか否かをどのように決めるのか?
Q. これから発表されるDavid Soltysikの論文に基づいてtSNRやSNRの用語を見直すか否か。
Q. 以後のプロファイルで、新しい動きのパラメータ推定法やDROによる検証について再検討する。
Q. 課題に相関した動きのプロファイル遵守への影響をより明確にする。
Q. コントラスト・ノイズ比(CNR)制限の根拠。
解決済みの問題:
1. エグゼクティブサマリー
このプロファイルは、脳手術や放射線治療の計画に用いる目的で、脳内の運動系の主要な構成要素をマップするためのfunctional magnetic resonance imaging(fMRI)の使用に関する手引きとなる。目下の焦点は、侵襲的治療において損傷の恐れがある手の運動に関連する脳領域の重心の位置バイオマーカとしてのfMRIの利用に関してである。したがって、このQIBAプロファイルの目的は、ユーザーにとってそのバイオマーカが有用で一定レベルの性能を発揮するものとなるよう、支援することである。
要件(セクション2)には、バイオマーカとその性能について書かれている。
アクティビティ(セクション3)は、バイオマーカの生成について述べている。要件を満たすために必要なアクティビティに関わるアクターについての必要要件が示されている。
評価手続き(セクション 4)は、ユーザーがこのプロファイルへの適合性を評価するのに役立つ特定の必要要件を評価するためのものである。
このQIBAプロファイル(治療前評価のツールとしてのBlood Oxygenation Level Dependent (BOLD) Functional MRIを用いた運動感覚野のマッピング)は、手術や侵襲的治療の治療計画のためのBlood Oxygenation Level Dependent (BOLD) fMRIの最適化への体系的なアプローチを提供する。このプロファイルは、被験者の取り扱い、画像データ収集、画像データ処理、画像QAおよび画像解析に関わる撮像装置、技師、放射線科医、後処理ソフトウエアや画像解析ツールについての必要要件を記載している。画像診断サービスで請求を行う予定のユーザーは、current procedural terminology(CPT)コードも参照することで、追加の必要要件を見つけることができるかもしれない。これについては、ASFNRのウエブサイト(http://www.asfnr.org/)をご覧いただきたい。
1.1 背景
課題によるBOLD fMRI(Thulborn K, 1982, Ogawa S et al, 1990)は、脳腫瘍やその他局在病変の治療のための侵襲的処置により損傷の危険のある機能的に重要な脳組織のためのバイオマーカとして用いられ得る(Medina LS et al 2005, Mahdavi A, et al 2015, Petrella JR et al 2006, Ulmer J et al 2004, Belyaev AS et al 2013)。BOLDのバイオマーカとしての臨床的有用性や専門的な容認は、課題により誘起されるBOLDレスポンスパタンの再現性や信頼性に依存する。このBOLDレスポンスパタンは、BOLD検査により生成される一次的な測定量であり、これより種々の二次的な定量的測定量が得られる(F riedman L et al 2006, Soltysik DA 2011)。現在の方法は、検査の実施から、データ収集、解析、結果の報告に至るまでのすべての段階で非常にばらついている。これは、大きくばらついたMRIスキャナ、データ収集システム、解析プラットフォーム、ソフトウエアコンポーネントに起因する(Glover et al, 2012, Gountouna V, 2010, Chen JE, Glover G, 2015)。この大きなばらつきのため、QIBA fMRI Technical Committeeの現在の優先課題は、現時点での最先端技術を明らかにし、fMRIの定量的測定量に悪影響を及ぼす、方法論におけるばらつきの主な原因を特定することである。
BOLD信号の再現性に関する我々の初期の研究は、以下に示す要件のステートメントの中で用いられる定量的な測定量を与える。この文書は、要件を満たすための必要要件述べているのであって、‘標準的なケアの必要要件’を述べているわけではない。このプロファイルへの適合性は、患者の適切なケアに比べれば二次的な問題である。
このQIBA BOLDプロファイル1.0は、個々の状況で目標とする臨床的実用性のレベルを満たすためにユーザーや装置開発者(ハードウエアおよびソフトウエア)により採用され得る。このプロファイルは、機能的に重要な脳領域におけるfMRIレスポンスが、決められた画像撮影、処理および解析の条件下で測定され、表示される精度に関する要件を与える。
この文書は、臨床医がこのバイオマーカについての意志決定を形作り、画像スタッフがこのバイオマーカを生成し、企業のスタッフが関連する製品を開発し、その製品の購入者や研究者がfMRIを中心課題あるいは主な要素とした研究計画をデザインする手助けになることを目的としている。
現在のプロファイルの限界と将来の発展への道筋:プロファイル第1版は手の自発運動に関わる脳領域の局在推定のためのバイオマーカとしてのfMRIの精度に意図的に狭く焦点をあてた。ここに述べた手続きを用いて、通常の日常臨床の中で要件が確実に達成されるために取り組まれるべき方法論的な因子や問題点の数をできるだけ少なくするために、意図的に焦点を狭く絞った。今後の版では、手以外(足、下肢、口)の部位の運動機能を支配する領域や、視覚、言語、さらにresting state fMRIのような他の画像技術にこのプロファイルを拡張することを目指すことになるだろう。さらには、以後の版では、要件をfMRIの活動の重心の位置から、活動の境界域や三次元的な領域、活動の大きさなどに拡張することになるであろう。このプロファイルの執筆者は、正確かつ有益な文書を作成するのに要した時間と努力に感銘を受け、これが、プロファイルの将来の拡張により、臨床的バイオマーカとしてのfMRIのすべての用途についてカバーするための強固な礎を築くものと信じる。
このQIBAプロファイルおよびCT、MRI、PETおよび超音波を用いた現在取組中の他の画像バイオマーカは、qibawiki.rsna.orgに掲載されている。
2. 臨床的背景と要件
BOLD fMRIは、腫瘍や血管奇形、てんかん焦点などの脳病変を持つ個々の患者において、治療前の計画や術中のガイダンスの道具として用いられている。fMRIは、隣接する病変に対する手術や放射線治療により障害の恐れがある正常脳組織を同定し、空間的にマップすることができる。症状や病変の位置により、マップすべき脳の部位が決められ、BOLDレスポンスを誘起するための行動パラダイム(例えば、運動課題、言語課題など)が選択される。このプロファイルは、基本的に手の運動を支配する脳領域をマップするためのfMRIに焦点をあてる。特定の手の運動(コントロール状態に比較して)により誘起されたBOLD信号の変化は、その運動を支配する脳領域とこの機能的に重要な皮質と治療される部位がどれほど近接しているかに関する情報を与える。病変近傍のBOLD fMRIマッピングにより、機能的に重要な脳組織へのダメージの可能性と術後の機能障害の可能性を知ることができる。このQIBAプロファイルの目標は、BOLD fMRIを正確で信頼性のある脳機能の予測法、すなわち、行動課題により誘起される医学的に意味のある脳活動の変化のバイオマーカとするために必要な手続きと定量的パラメータを示すことである。
BOLD fMRIの利用に関する前提条件を以下に示す:
仮定1-fMRI神経血管共役:感覚刺激や行動課題の開始/中止に同期するBOLD fMRI信号は、刺激/課題に対する局所の血行力学的反応の正当な指標(バイオマーカ)である。さらに、血行力学的反応は局所のニューロンの反応の指標である。(この仮定を支持する背景についてはAppendix Bを参照)
仮定2-機能的特異性:課題Pにより脳領域Aに引き起こされるBOLD信号の増加は、脳領域Aの機能の正当な指標である(このことは、脳領域Aを切除または障害すると機能に関連した神経学的欠損を生じることを意味する)。関心領域は他の領域と相対的に区別できることも仮定される。(この仮定を支持する背景についてはAppendix Bを参照)
測定されるバイオマーカ:局所のT2* MRIコントラスト(脳活動の変化に対する血行力学的反応を反映する)-しばしばBOLD fMRI信号と呼ばれる。一次的な関心測定量は、課題により決められた手の運動により誘起された、運動感覚野内のfMRI賦活域の重みづけ重心(wCMA)の位置である。ボクセルのfMRI信号の振幅あるいはT統計量が事前に決められた閾値を超える場合、そのボクセルが賦活部位に含まれると判定される。賦活部位に含まれるすべてのボクセルのfMRI信号の振幅は、重みづけ重心の計算における重みづけ係数として使用される。(wCMAの詳細についてはセクション 3.9とAppendix Iを参照)
以下の要件の有効性を確認するためには、全ての関連するアクターと設備がこのプロファイルに適合していることが必要である。
要件1:X、Y、ZがfMRIの手運動による単一の賦活域の重みづけ重心(wCMA)の測定位置としたとき、真のwCMAのX、Y、Zの95%信頼区間は、いずれの方向についても+/- 5mmである(systematic biasはないと仮定する)。(+/- 5mmの精度は、1.96×被検者内標準偏差を表す)
3. プロファイルアクティビティ
このプロファイルは“アクター”が“アクティビティ”を実施するという形式で記述されている。“アクター”は個人(例えば技師)の場合もあり、装置(例えばMRIスキャナ、ビデオディスプレイなど)やソフトウエア(例えば後処理ソフトウエアなど)の場合もある。fMRIにおけるアクターとアクティビティをTable 1にまとめており、同時にこのプロファイルのどのセクションに個々のアクティビティの詳細が述べられているかも示している。それらのセクションには、このプロファイルへの適合を資格づけ、実施者がプロファイルの要件を満たすことができるようになるはずの必要要件が書かれている(評価手続き、セクション4も参照)。Table 1に挙げられているアクティビティの臨床での一般的なワークフローをFigure 1に示す。
Table 1: アクターとアクティビティ
| アクター | アクティビティ | セクション |
|---|---|---|
| N/A | 開始前 | 3.1 |
| MRスキャナ供給業者/Physicist/周辺システム供給業者 | 設備導入 | 3.2 |
| 供給業者/技師/研究者 | 定期Q/A | 3.3 |
| 臨床医/研究者/技師 | 被験者選択 | 3.4 |
| 臨床医/研究者/技師 | 被験者の取り扱い | 3.5 |
| MRスキャナ供給業者/技師/臨床医/研究者 | 画像データ収集 | 3.6 |
| 技師/研究者/画像アナリスト | 画像Q/A | 3.7 |
| 供給業者/技師/研究者/画像アナリスト | 画像データ処理 | 3.8 |
| 供給業者/技師/研究者/画像アナリスト | 画像解析 | 3.9 |
| 臨床医/研究者/技師 | 画像解釈および配布 | 3.10 |
アクターは各セクションに書かれた全ての必要要件に適合することで、リスト中のアクティビティを担当することになる。このプロファイルの中の必要要件は、標準治療を述べたものではない;要件を達成するための手引きを示しているだけである。このプロファイル中の“shall”に適合できない場合、プロトコルからの逸脱となる。逸脱はプロファイルの要件達成を無効にするが、そのような逸脱はしばしば合理的かつ避けがたいものであり、放射線科医や臨床指導医は患者や研究被験者の利益を鑑みて逸脱を求められることがある。ここで述べる必要要件は、fMRIの最低限の機能を確保することを意図されている。より高いパフォーマンスや高度な機能の提供は、容認され、かつ推奨されるものであり、このプロファイルは決して機能を制限することを意図していない。このプロファイルは、fMRI検査を患者に行う医学的な根拠を示すことを意図していない。fMRIの適切性・適応は、検査を依頼する臨床医が患者の病歴や症状、治療法、予後、その他の情報に基づいて決定するものと想定されている。さらに、臨床医はfMRI検査が患者の医学的状態を評価し、診断し、治療するために有益な情報をもたらすと判断しているものと、想定されている。
このプロファイルで示されているアクティビティの流れをFigure 1に示す:
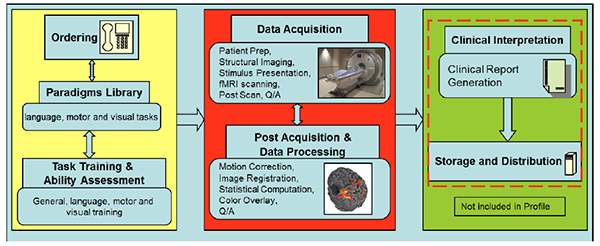
Figure 1:術前評価ツールとしてのBlood Oxygenation Level Dependent(BOLD)functional MRIによる脳領域マッピング―アクティビティの流れ
3.1 開始前
このプロファイルでは、開始前に必要なアクティビティは特にない。
3.2 設備導入
3.2.1 考察
プロファイルの要件を達成できることが想定される実施施設は、通常、以下を備えている:
- functional MRIの機能を備えたMRIスキャナ
- fMRI運動課題の指示を行う視覚または聴覚刺激を与えたり、患者の課題遂行を記録するための周辺機器
- fMRI運動課題の遂行法の患者への指導なども含めたfMRI撮影手続きの訓練を受け、経験を積んだMR技師、医師あるいは研究者
- 画像後処理や表示のためのソフトウエア・ハードウエアと、後処理の実施の訓練を積んだ技術者
- 以下に示された仕様に適合する能力が示されていること
ひと揃いのfMRI検査では通常、解剖・形態画像と、関心のある脳領域をカバーするために必要な行動課題に応じた、いくつかのfMRIスキャンを含んでいる。異なる撮影シリーズ間でミスレジストレーションを最小限に抑えるために患者にできるだけ動かないように指示するため、全ての画像は単一のセッションで取得するのが理想である。
fMRIデータ撮影では、通常数分程度以上かかる1回のスキャン中に、脳の画像ボリュームが繰り返し(例えば2秒ごとに)撮影される。スキャンの間には、患者は行動課題を遂行する。患者の課題遂行のデータが記録されるなければならない。データ記録一式には、脳画像、fMRIのパルスシーケンスと撮影条件の記述、同期トリガー信号の記録、課題内容の記述と実際の課題遂行のデータ、さらにMRI技師によるあらゆる偶発的所見の記録を含む。全てのデータが臨床記録に含まれることが必須であり、後処理や記録保管、医師の臨床的解釈へと引き渡されることが必要である。
fMRIのスキャンは、高品質の撮影装置で行われなければならない。磁場強度1.5 Tesla以上でfMRIの機能を持つ装置の使用が推奨される。CPTコードの基準を満たすために、撮影中には適切な人員が参加することも重要である。
ハードウエアの機能と安定性を検証するために、施設は保有する装置の品質保証試験を行うことが強く推奨される(詳細はセクション3.3.1を参照)。そのようなハードウエアの試験は、スキャナの信号と画質をテストするための日1回のSNRやtSNRの測定に加え、患者をスキャナに入れる前に行う、fMRIに固有の装置の操作試験(すなわち、反応機器、プロジェクタ、ゴグル、聴覚装置など)を含むべきである(Glover et al 2012、Glover et al 2011)。ハードウエア以外に由来する変動も大きく寄与するため、ハードウエアのテストだけでは、データの品質全体を保証するために十分ではないことに注意すべきである。
刺激表示/反応装置―視覚刺激/指示は、両眼視ゴグルやプロジェクタシステム(液晶モニタまたはプロジェクタ)などのMR対応機器を通じて表示することができる。聴覚刺激はMRスキャナに付属の聴覚提示システムまたはMR環境用に設計されたサードパーティシステムを用いて提示できる。課題遂行の監視(指/手/足の動きの直視)および患者の反応(例えば押ボタンボックスやその他の機器)の記録が必須である。
fMRIの刺激提示機器(例えばゴグルや鏡/表示システムなど)は、視覚的明瞭性を正しく調整し、視覚ディスプレイの全体が患者から見えるように、適切に調整することが重要である。これにより、スキャン中に横目で見たり、眼や頭が動いたりすることを防ぐことができる。眼鏡のフレームや不適切な位置合わせにより視覚ディスプレイの一部が隠れることは、fMRIの結果の不良につながる。ボアの外から調整不良を評価するのはむずかしいため、スキャナの技師あるいは助手が、スキャナ内の患者の位置からテスト刺激を確認することが強く推奨される。聴覚刺激の場合、音量の適切な決定のために、ヘッドフォンの位置や調整が重要である。運動反応をモニタするために、MR対応のボタンボックスやグリップ機器、トラックボールは、患者が無理なく、頭をうっかり動かすことなく、機器を容易に操作できる位置に設置しなくてはならない。頭部の動きを減少させるために樹脂のパッドを使用すること、また、聴覚提示システムを使用しない場合は、スキャナの騒音の影響を減少させるために樹脂の耳栓を使用することが勧められる。
患者をMRスキャナの中に入れたあと、簡単に課題を復習し、患者がこれから何を見たり聞いたりするか、課題として何をするかをまだ理解していることを確認することが推奨される。
以下の仕様によりプロファイルの要件を満たすことが可能になる。他の仕様でも要件を満たすことが可能だが、その場合、アクターはこのプロファイルに適合することを示すことが求められる(評価手続き、セクション4を参照)。
スキャン同期/トリガリング―課題遂行の時系列はfMRIの撮影シーケンスと同期されていなくてはならない。最もよい方法は、視覚あるいは聴覚指示の提示の開始を電気トリガーパルスによって行うことである。これにより、正確で自動的なfMRIレスポンスの検出が可能になり、より質の高い信号を得るために複数のスキャンを加算平均することができるようになる。撮影中の実際のタイミングやトリガー信号のオンライン記録を最終的なデータとして記録することが可能で、かつ強く推奨される。
3.2.2 仕様
| パラメータ | アクター | 必要要件 |
|---|---|---|
| 刺激ディスプレイ仕様(聴覚/視覚) | 刺激提示機器/ソフトウエア | 患者が容易に見る/読める表示サイズ、または容易に聞く/理解できる音声のような適切な質の刺激を提示する |
| 反応機器仕様 | 反応機器または技師 | 行動測定量(例えばボタン押し、手指の動き)を自動的に記録できる、または技師が患者が課題の指示を履行していることを見て確認する |
| MRIスキャンと課題の同期 | 同期機器 | MR画像取得と刺激課題の提示が、+/- 100 msec以内の精度で同期できる。 |
3.3. 定期的QA
3.3.1 考察
下のTable 3.7.2.に示される因子および次の事項(Friedman L et al, 2006、Olsrud J, et al, 2008、ACR QC Manual, 2015)を評価するために、大きな水ファントムあるいは供給業者から提供される適当な頭部ファントムを用いてQAスキャンを実施することを推奨する。
- functional BOLDスキャンのためのEPIスキャンのゴーストの強さ
- 他の装置からの干渉の可能性
- 傾斜磁場によるスパイク
- 傾斜磁場の非線形性と画像の歪
3.3.2 仕様
| パラメータ | アクター | 必要要件 |
|---|---|---|
| スキャナの性能 | 供給業者 | 定期的に供給業者推奨のスキャナテストを行って、スキャナが仕様を満たしていることを確認する |
| 反応機器 | 技師 | 検査時に反応機器が動作していることを確認する(使用する場合) |
| 刺激提示機器 | 技師 | 検査時に刺激提示機器が動作していることを確認する |
| Signal to Noise Ratio(SNR) | 技師 | SNRが200:1以上であることを確認する(Friedman L et al, 2006;fBIRN Study) |
| Temporal SNR (tSNR) | 研究者 | tSNRが0.71×セクション4.5で指定された手続きでのファントムの平均SNR以上であることを確認する。不安定性ノイズが生のノイズ以下であることを確認する(Greve, et al, 2011)。 |
3.4 被験者の選択
3.4.1 考察
課題fMRIの信号は、fMRIスキャン中の患者の運動感覚課題の遂行により誘起される。患者の病気やそれに関連した機能の欠損が課題遂行能力に影響する可能性があり、測定される信号の特異度に大きく影響し得る。課題内容を選択し、課題遂行の予測値を決めるとき、患者の病気のみならず、技能や能力についても考慮すべきである。このため、一貫した患者の技能の評価基準と対応する課題選択が、得られるfMRIデータがこのプロファイルの要件に適合させるのに役に立つ。
3.4.2 仕様
| パラメータ | アクター | 必要要件 |
|---|---|---|
| 撮影前の患者の能力 | 医師または研究者 | 患者が機能的に適切な課題を少なくとも最小限遂行できることを確認しなくてはならない |
3.5 被験者の取り扱い
3.5.1 考察
課題パラダイム選択―課題パラダイムは単純である一方、患者がその遂行に適当に没頭する程度に十分むずかしくなくてはならない。放射線科医や臨床指導医は、患者の能力に配慮して課題を変更したり、遂行の基準を緩めたりしてもよいが、その場合はfMRIデータはプロファイルの手続きに適合せず、要件を達成できない可能性がある。課題は、機能的に特異的でなくてはならないが、それはその課題が課題の遂行に必要な脳領域が再現性よく賦活し、課題遂行に本質的でない脳領域の賦活が最小限であると示すことを意味する。以下の仕様に適合するためには、課題は十分な振幅のBOLD信号を生じなくてはならない。もし、fMRIデータが複数の撮影セッション(すなわち術前後)に渡って取得され、比較されるときは、結果の再現性を高めるために、それぞれのセッションで同一の課題を用いなくてはならない。このプロファイルの要件を作成するのに用いた両手運動課題の詳細な仕様を含めたパラダイムデザインのより完全な考察は、Appendix Dに記載されている。
被験者の訓練-患者は、MRIスキャナに入る前に、指定された行動課題を遂行する訓練を受けるべきである。一貫した訓練と評価により、課題遂行についての不安や、検査結果に悪影響を及ぼす課題遂行の不良を避けることができる。患者に検査の流れ(例えば課題の順番、課題が指示される時間についての予想など)に関する情報を伝えることが重要である。患者がMRスキャナに入ったことがない場合は、技師が騒音や不快感などに関してどんなものかをひと通り話しておくべきである。訓練の後、患者は課題やその期待される遂行に慣れておくべきである。
課題のタイプ、何らかの変更点および患者の課題遂行を記録/記載しておくことは、fMRIスキャンの結果の正しい解釈のために必須である。訓練での課題の遂行の評価と記録は有益であるが、fMRI撮影中のスキャナ内での課題遂行の記録の代わりになるものではないことに注意が必要である。
患者のポジショニング―一貫性のある体のポジショニングにより、不必要な注意状態の変化や重力による形や体液の分布の変化、あるいは姿勢に伴う解剖学的な形態の変化、ねじれなどを避けることができる。
適切なポジショニングは、快適で目に見える筋肉の緊張の維持はなく、スキャン中の患者の動きを最小限にとどめる。画像ファイルヘッダー内への患者の位置やテーブルの高さの自動記録は、基本的な状況をチェックし再現するために推奨されるが、MRIスキャナの撮影ソフトウエアの望ましい機能でもある。被験者の体のポジショニングについての重要な要素には、腕の位置、背中や膝の下に枕を置くことによって決められる脊柱の前後方向の弯曲、脊柱の左右方向の直線性が含まれる。両手は離しておかなければならず、導電ループの形成を避け、傾斜磁場による人工的な筋肉の刺激を最小限にとどめるために、接触させてはならない。患者が仰臥位の場合、腰椎の前弯を直線化させ、肩甲骨をテーブルにつけるために、膝や頭の下にポジショニング用の楔を使用することが推奨される。しかし、枕の正確なサイズや形などは、プロファイルの要件に大きな影響を与えるとは考えられない。臨床試験の文書や個々の施設での臨床実地では、好ましい患者のポジショニングを指定してもよい。
頭部の動きはfMRIデータの質を強く低下させ、場合によっては破壊することもある。頭部をぴったりとフィットする局所傾斜磁場やRFコイル内にポジショニングすることは、患者の快適性、頭部の動きの抑制、視覚刺激ディスプレイの良好な視認性、ヘッドフォンやイヤフォンの使用に重要となり得る。頭部用コイルは、このための適切な空間を与えるはずである。頭部の動きを低減するために樹脂製パッドなどを用いることが重要である。頭部パッドを用いて頭の背側腹側軸がスキャナのZ軸に平行になり、横方向のねじれをできるだけ少なくなるように位置合わせすべきである。
被験者の準備として、視覚刺激の明瞭性を確保するための視力の矯正、そして音声刺激の音量の調整も行わなくてはならない。臨床試験の文書や個々の施設での臨床実地では、刺激提示機器が、製造/供給業者のマニュアルに沿って適切に設置されたことを確認する方法を記載することが求められる。
師はスキャンの合間に頻繁に患者と会話し、快適性と注意の状態を評価し、断続的に指示や激励を行うべきである。また、患者に撮影が始まったら頭部の動きを避けることを何度も思い起こさせ、スキャン間の頭部の位置合わせの維持のため、スキャンの間での動きも避けることを強調することは、有益である。
3.5.2 仕様
| パラメータ | アクター | 必要要件 | |
|---|---|---|---|
| 課題の選択 | 医師/研究者/技師 | Appendix Cに書かれているパラダイムあるいは以下のような類似のパラダイムを用いる: ・被験者の遂行能力に見合っている ・運動野(例えば一次運動皮質、運動前野皮質、SMA、小脳、基底核)および関心のある亜区域(例えば手の領域)に機能的に特異的 ・セクション3.7.2に示される質的仕様に適合するfMRI信号を発生することができる |
|
| 被験者の訓練 | 技師/医師/研究者 | 検査で行う課題パラダイムについて被験者を訓練し、課題遂行を観察/記録する | |
| 被験者のポジショニング | 技師 | 可能であれば被験者を仰臥位にポジショニングし、上に述べたように固定用の楔を用いて頭部を固定する | |
| 周辺機器の調整 | 技師 | 患者が刺激を明瞭に見る、あるいは聞くことができ、周辺機器により妨げられないことを確認する患者が頭部の動きを生じることなく、反応機器(もしあれば)を操作できることを確認する | |
| 課題 | 技師/医師/研究者 | 患者がAppendix Cに指定されている課題を遂行することができることを確認する | |
| 課題のタイミング | 技師/医師/研究者 | 許容可能 | 180 sec,(9-30 sec ON,9-30 sec OFF)×5 |
| 理想的 | 4 min, (20 sec ON, 20 sec OFF)×6 | ||
| スキャンの長さ | 技師/医師/研究者 | 課題の長さプラス最初のスキャナ平衡スキャン(この部分は捨てる)に合わせる | |
| 課題の遂行 | 技師/医師/研究者 | 許容可能 | 手動で観察し反応の適切性/安定性を評価する |
| 理想的 | 反応のタイミング、大きさ、スピードを反応機器インターフェースを通じて自動的にハードウエア記録する。記録された遂行のデータを、間違いや不実施に気を付けながら評価する | ||
| 被験者との面談(検査後) | 技師/医師/研究者 | 許容可能 | 被験者に課題を遂行したことを確認する |
| 理想的 | 患者に面談し、課題遂行の自己評価を記録する | ||
3.6 画像データ取得
3.6.1 考察
解剖/構造画像
MRIスキャンの撮影は、通常、磁場の不均一を補正するためのシムスキャンとスライス位置を決めるための位置合わせスキャンを最初に行う。その後、通常は、脳全体のT1またはT2強調画像の解剖画像のスキャンを撮影する。解剖画像の撮影は、機能画像の撮影の前、後または途中のいずれでも行い得る。
functional MRの画像は通常、十分詳細な解剖学的情報を持っていない。したがって、高分解能の解剖画像のスキャンを、functional MRIのスキャンと同じセッションの中で行うことが必須であり、両者の間に患者の動きがないことが望ましい。スキャンの間の頭部の動きは、機能画像と解剖画像のレジストレーションを劣化させる可能性がある。
機能画像
一般にfMRIのシリーズは、典型的には1-3秒の等間隔で撮影された一連の画像ボリュームから成る。おのおのの画像ボリュームはユーザーにより指定された解剖学的領域(典型的には全脳)にわたるスライスを含んでいるが、解剖画像の撮影範囲より狭い領域の場合もある。1つのfMRIシリーズの撮影時間(通常数分間)は、繰り返し時間(TR)とスキャン中の測定の総数により決まる。BOLD T2*強調画像は通常、1つ1つの画像あるいはモザイクとしてスキャナ上で再構成される。多くのシステムにおいて、画像とfMRI信号の時間変化を、撮影中または撮影直後に見ることができ、fMRI信号が高い質で得られていることを確認できる。
行動課題―fMRIスキャンでは、患者は10-30秒のエポックの間、運動課題(例えば手指の繰り返しタッピング運動)を継続して遂行し、これと同程度の長さの休止のエポックとを少なくとも3サイクル交互に繰り返す。この運動と休止の繰り返しが、対応する中枢運動系のニューロン活動を引き起こし、その結果、BOLD T2* fMRI信号を生じる血管運動性変化を誘起する(このプロファイルの要件を作成するために用いた両手運動課題の詳細についてはAppendix CおよびDを参照)。
課題遂行のモニタリング―スキャン中の患者の課題遂行のモニタリングは強く推奨される。課題が遂行できなかったり、貫徹できない場合、fMRIデータを劣化させ、さらには使用不可能にすることがある。また、課題遂行の評価を各スキャン後に記録することも推奨される。いくつかの推奨される課題遂行のモニタ法が以下に述べられている。
行動の定性的評価-被験者の課題遂行およびスキャン全体の成否を各スキャンの直後に定性的に評価して記録することは、有益である。至適状況からの逸脱を全て書き留めることで、スキャン結果の臨床的解釈に影響し得るあらゆる潜在的な問題点を医師に警告することに用いられる。
解剖画像データの分解能は、fMRIデータが最終的に解剖画像に合わせてリサンプルされる場合、それに影響し得る。fMRIの分解能の損失を防ぐために必要な許容できる解剖画像の分解能は少なくともfMRIと同程度であるが、通常はそれより高い。
B1/B0磁場マップ:理想的には、B1/B0磁場マップをfMRI画像と同じ解剖学的断面で取得すると有益である。B0磁場マップの取得はプロトコルの必須要素ではないが、fMRI生データの幾何学的歪みを補正するのに使用できることがある。
3.6.2 仕様
3.6.2.1:代表的な解剖画像撮影パラメータ
| パラメータ | アクター | 必要要件 |
|---|---|---|
| 画像タイプ | 技師 | 以下にうち少なくとも1つを撮影:T1強調画像、T2強調画像、FLAIR |
| 解剖学的な撮影範囲 | 技師 | 全脳をカバーする画像を撮影 |
| Field of View | 技師 | 全脳を撮影(必須)、等方性ボクセル(推奨) |
| 分解能 | 技師 | fMRIと同じまたはより高い分解能の解剖画像を撮影―(推奨1 mmm3) |
| 撮影断面(画像の向き) | 技師 | 解剖に対しその向きでも可(上の分可能の項を参照)-腫瘍の位置/向きと全脳カバーに最適化 |
3.6.2.2:代表的なfMRI撮影パラメータ
| パラメータ | アクター | 必要要件 | |
|---|---|---|---|
| BOLDパルスシーケンス | 技師 | 許容可能 | T2*強調Echo Planar Gradient Echoシーケンス(個々のパラメータについてはAppendix Dを参照) |
| 解剖学的撮影範囲/Field of View | 技師 | 許容可能 | 関心領域をカバーする画像を撮影(解剖の向きに合わせる) |
| 理想 | 全脳 | ||
3.7 画像QAチェック
3.7.1 考察
fMRIデータの処理のあと、fMRI画像データの評価と臨床的な解釈に影響し得る質的問題点を見出す経験を積んだアナリストによる全体的な質の評価を行うべきである。アナリストは過度の頭部の動きやその他の信号のアーチファクトの有無を検討し、患者の課題遂行の記録を見て、被験者の自己申告に関わらず、失敗や不適切な遂行について検討すべきである。
神経血管脱共役-手術を行う病変の近傍における神経血管脱共役(NVU)の可能性について常に評価すべきできある。NVUの関連した健全な組織のfMRI信号の消失は、術後の衰弱性の神経機能欠損につながる可能性があるため、これは術前計画において必須である(Pillai J et al, 2011)。息止めやその他のNVUのための試験を行った場合、その結果を検証し、要約を解釈を行う医師への報告書に含めるべきである(Pillai AJNR 2015, Pillai & Zaca 2012)。評価の手続きについてはセクション4.3を参照。
患者の動き-患者の頭部の動きは、最もよく見られるfMRIデータにおける変動の原因である。極端な場合、fMRIデータが使えなくなることがある。より軽度の場合は、プロファイルへの適合性を損なったり、正確性や感度を低下させ得る。fMRIの課題と時間的に同期した頭部の動きは特に破壊的だが、ランダムに起こるものはしばしば容認できる。これについては、fMRIデータそのものから、スキャナやサードパーティのソフトウエアを使って計算できる。Appendix Jにこのトピックに関するより詳細なディスカッションが、補償法と共に述べられている。
Contrast to Noise Ratio(CNR;課題依存)-CNRは、背景ノイズに対する、課題により引き起こされるfMRI信号の質を表す。賦活域の重心などの信頼性のある測定のためには、最低限のCNRが必要である。様々なソフトウエアパッケージ(例えばAFNI)を使って、ボクセルごとのCNRを計算することができる。適合性を評価するために、fMRI賦活関心焦点(例えば運動皮質の手の領域など)をユーザーが設定した閾値を用いて同定し、関心焦点内の全ての閾値上のボクセルのCNRを計算する。適合するためには、Table 3.7.2に示される下限値と同等以上のCNRを全ての閾値上のボクセルが示さなければならない。これは、セクション4.2で述べる評価手続きにより計算される。
3.7.2 仕様
| パラメータ | アクター | 必要要件 |
|---|---|---|
| 磁場不均一性 | 技師/医師/研究者/画像分析者 | 生のEPI機能画像を解剖画像と比較することにより磁場の歪を評価し、歪みの程度が賦活域の位置が真の解剖学的位置からボクセルの大きさ以上に偏位しているかどうかを決定する |
| 神経血管脱共役 | 医師/研究者/画像分析者 | 反対側の一次運動感覚野の賦活域内のROIを評価し、対側半球に同等の賦活焦点が存在するかどうかを調べる。NVUを正しく評価する方法についてはセクション4.3を参照 |
| 頭部の動き | 技師/医師/研究者/画像分析者 | スキャンを通じて頭部の動きをモニタし、瞬間の頭部の動きのSSDrmsが1mm以内でMCMrmsが3mm以内であることを確認する。詳細はAppendix Hを参照 |
| Contrast-to-Noise(課題依存) | 技師/医師/研究者/画像分析者 | それぞれの賦活域内の全ての賦活ボクセルについてcontrast-to-noise ratioが1より大きくなることを確認する。セクション4.5.2を参照 |
3.8.画像データ処理
3.8.1 考察
MRIスキャナ内の生の(Kスペース)データを時系列画像に変換し、磁場不均一や被験者の動きなどの種々の因子を補正し、fMRIの時系列信号を脳賦活マップに変換するために、撮影後の画像処理が必要である。
Appendix Fには、このプロファイルの要件を満たすデータの解析で使用される処理のステップを記述している。この手続きは、この分野で用いられるものの中で代表的なものではあるが、必ずしも最も適した方法あるいは全ての実施者に好まれるものでもない。多くの施設で別の処理法が使われ、それでもプロファイルの要件を達成できるかもしれないが、この委員会によって認証されてはいない。fMRIの処理や統計解析は、スキャナの製造会社やサードパーティベンダーが提供するソフトウエアで行うことができる。この目的のために、様々なソフトウエアやアルゴリズムが利用できる(Friston K et al, 1995, 2007; Hyde JS 2012, Poldrack R et al, 2011; Smith SM et al, 2004; Jenkinson M et al 2012)。
以下のディスカッションは、解析のキーとなるステップを取り上げ、個々のステップで生じ得る問題について少し議論する。生のfMRI撮影データは通常、スキャナ供給業者が提供するソフトウエアを使ってDICOMに準拠した画像データに変換される。上級ユーザーの中には別の好みの方法を使う者もいるが、通常の臨床用途ではあまり行われない。したがって、Appendix Table Fに示される後処理の流れでは、DICOM画像がスキャナから取り出されるところから始める。
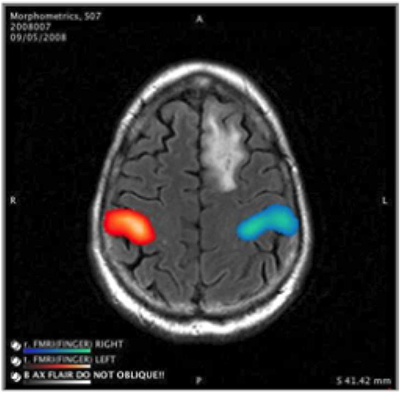
fMRIデータはスキャン中に繰り返し(TRごとに)撮影された3D画像ボリュームから成る。したがって、各脳ボクセルのfMRI信号は経時的に振幅が変化する波形となる。正しい課題関連のfMRIレスポンスは、通常課題(例えば手指タッピング)遂行時は高く、間に挟まれた休止時間では低いという、課題エポックのタイミングを反映した波形を示すようになる。しかし、本物であるが弱い反応はノイズやアーチファクトにかき消されており、そのような効果を選択的なフィルタや信号の条件づけにより低減するために、後処理法が用いられる。それぞれのボクセルの信号は通常、SNRを改善するために、3次元空間内で球形ガウスカーネルを使って平滑化される。その結果得られる信号はさらに、あらゆるDC、直線または追加の低次トレンドを含めたトレンドの除去を行う。手動または自動で検出されたアーチファクトを除去し、スライスタイミングのずれを補正する。スキャン中の頭部の動きは通常、BOLDスキャン内のコレジストレーションやT1またはT2強調画像とのレジストレーションによって検出され、測定され、補正される。レジストレーションの変形規則は保存され、後のQ/Aチェックで使われ、目立った患者の動きを記載するのに用いられる。様々な統計学的手法(GLM、相関など)を使って、真の反応を検出し、統計学的な計量を得ることができる。最後に、fMRI賦活データを使って、疑似カラーの脳機能マップを作成することができる(Figure 2)。このようマップは通常、エンドユーザーによって、2Dの構造画像に重ねたり、立体的な3D脳マップとして閲覧される。異なる行動課題のそれぞれに関連したマップが作成される。これらのマップはDICOMあるいはスキャナやPACS、保存管理システム固有のフォーマットで保存される。その後fMRIデータは通常、臨床的な解釈に役立つ追加のデータと結合される(セクション3.10参照)。
機能画像処理ソフトウエア-fMRI画像後処理は、一貫性を高め、臨床的解釈に迅速に供することができるよう、可能であれば自動的なソフトウエアで行うことが推奨される。しかし同時に、後処理は解析を監視し、問題点を発見し、計算が正確に行われているかどうかを判断できる知識豊富な技師によって行われることも推奨される。一般的に、結果に悪影響を及ぼす計算上の問題点を見つけ、検査結果を解釈する医師が理解できるように記述するのは、技師の責任である。
磁場の不均一の補正/補償-局所磁場の不均一は、側頭葉内側部や前頭葉下部でしばしば見られるように、骨構造や空気に近接する脳内に部分的な空間的歪みや信号の欠落をもたらすなど、BOLD T2* echo planarイメージに影響を与える(Belaroussi B et al 2006)。fMRIデータ撮影の直前または直後に磁場マップを取得し、適切なソフトウエアでこれを歪みの補正の使うことにより、これらの影響を補償することはある程度は可能である。磁場マップが利用できない場合 は、生のBOLD画像を大きな歪みがないか視覚的にチェックし、手動で動かしたり変形させたりして部分的に補正することもできる。磁場の不均一の影響の補正は全て記録し、臨床的解釈を行う医師に逐一報告すべきである。磁場の不均一に特に影響されやすい領域のfMRI信号にことさら興味がある場合は、z-shim BOLDシーケンスなどの特殊なパルスシーケンスを使うことができる(Hoge et al, 2013)。
動き補正の使用-頭部の動きの補正は、スキャンを通して撮影されるfMRI画像ボリュームをコレジストレーションしたり、回帰やその他のテクニックを使って補正できる。詳細については、Appendix Hを参照。動き補正は実際に広く使用されているが、ある条件下では、偽陽性の賦活を生む可能性があり、その使用にはいまだ議論がある(Freire L et al 2001)。補正はしばしば真の信号の検出力を改善するが、一部の被験者やスキャンでは、ときに信号の検出を低下させることが知られている。頭部の動きの理想的な対策は、撮影時に動きを取り除くことである。しかし、患者を対象とする場合、ある程度の頭部の動きは避けがたく、そのようなときには、動き補正はデータをかろうじて使えるようにできるかもしれない(Cox RW et al 1999; Friston KJ et al, 1996; Jiang A 1995; Oakes TR et al 2005; Soltysik DA et al 2006, 2011; Mazaika PK 2007)。
3.8.2 仕様
| パラメータ | アクター | 必要要件 |
|---|---|---|
| 機能画像と解剖画像のコレジストレーション | 医師/研究者/供給業者/画像分析者 | 患者の機能画像を解剖画像にコレジストレーションする |
| 空間的平滑化 | 医師/研究者/供給業者/画像分析者 | 機能画像の撮影ボクセルサイズの2倍のFWHMを使う(SPMのマニュアルを参考文献の追加) |
| 統計パラメトリックマップの作成 | 医師/研究者/供給業者/画像分析者 | 一般線形モデルまたは相互相関を用いて全脳の統計パラメトリックマップを計算する(Student tまたはr 相関係数) |
| BOLDマップの閾値処理 | 医師/研究者/供給業者/画像分析者 | 運動皮質の近傍でfMRI賦活のピークを同定し、閾値をピーク値の50%に設定する。Appendix Fを参照 |
| 関心領域の同定 | 医師/研究者/供給業者/画像分析者 | 同定可能であれば中心溝の近傍に、可能でなければ前頭葉後部と頭頂葉前部の間に運動皮質を同定する |
3.9 画像解析:重みづけ重心バイオマーカの計算
3.9.1 考察
このプロファイルの主な要件(セクション2)では、fMRI賦活域の重みづけ重心(wCMA)の脳内の3次元的な位置の測定精度を指定している。下にwCMAの計算式を示している。精度の要件は、wCMA測定の撮影セッション内および間での再現性に基づいて、セクション2に示した。後者はMRIスキャナ内での患者の正確な位置(そして画像ボクセルマトリックスとの相対的な位置)が含まれるので、セッション内測定の場合よりばらつきが大きくなる傾向にある。
賦活域のwCMAの計算には、統計学的に有意な賦活を示し、それによりfMRI関心域に含まれたり含まれなかったりするボクセルを同定するための特定の基準(閾値)の設定が必要という点が重要である。これは本質的に統計学的な基準であり、特定の患者のfMRIデータの信号雑音比のもとで、偽陽性や偽陰性の信号を包含/除外する確率を決定する。脳腫瘍の切除をガイドするにあたり、この選択は健全な脳組織をうっかり切除するリスクと逆に腫瘍を完全に切除できないリスクに影響する。fMRI信号の大きさの計量の正規化(例えばT統計量など)により、その計量ひいては閾値を異なる撮影セッションや患者にわたってより一貫性のあるものにし、これらの因子によるwCAM測定のばらつきを低減することに役立つ(Voyvodic, 2009,2012)。追加の情報についてAppendix Fを参照。また、単一のfMRI関心域が同定され、それを構成する賦活ボクセルの位置座標が得られているものと仮定している点にも注意。これは典型的には、関心領域(ROI)をfMRIの関心域だけを取り囲むように設定して、ROI内の基準閾値を超えるボクセルの座標を読み取ることで行うことができる。様々なソフトウエアパッケージにこのためのツールが含まれている。
3.9.2 仕様
重みづけ重心の計算式:
基準の賦活レベルを満たすN個のボクセルを仮定し、それらの位置座標[xi, yi, zi]とfMRI信号の振幅計量[Ti]とした場合、重みづけ重心の座標[X Y Z]は:
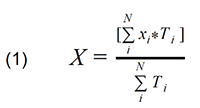 ・・・Y、Zも同様
・・・Y、Zも同様
| パラメータ | 定義 |
|---|---|
| wCMA座標(XYZ) | mmで表される、手運動により誘発される運動感覚野内のfMRI賦活域の重みづけ重心 |
| ボクセル座標(xi yi zi) | mmで表される閾値基準以上の振幅をもつボクセルの位置座標 |
| fMRI振幅計量(Ti) | 課題に関連したfMRI信号成分のT統計量または正規化T統計量 |
| 閾値基準 | 許容される最小のfMRI振幅計量 |
3.10 画像の解釈と配信
3.10.1 考察
fMRI検査結果のパッケージには、医師が結果の解釈を行うために有益な全ての情報を含んでいなくてはならない。少なくともTable 3.10.2に記載されたデータを含む必要がある。
通常、検査データはfMRI画像データを解剖画像に重ねて閲覧する(Figure 2)ためのソフトウエアを備えたワークステーションやPACSに転送され、fMRI賦活(健常組織)と手術の対象となる病変との近接の程度や周囲の解剖学的状況を評価する。通常、画像はDICOM Secondary Capture(SC)フォーマットの、全ボリュームシリーズまたは選択されたスライスや合成画像であるが、各施設で使われる特定の閲覧ソフトウエアに互換性のあるフォーマットで送信することも可能である。経験豊富なアナリストは、しばしば、検査内容のまとめと、医師が結果の解釈の際に考慮に入れる問題点、特に画像の質や正確性に影響した可能性があるあらゆる因子について取り上げた技術的な報告を作成する。その後、検査結果は、医学的解釈を行う医師に手渡される。最後に、データは記録・保管されるが、将来再評価される場合に備えて以下に挙げる全ての項目を含むべきである。
3.10.2 仕様
| パラメータ | アクター | 必要要件 |
|---|---|---|
| fMRI時系列画像ファイル | 医師/技師 | 報告にはDICOM時系列画像を含める |
| 解剖画像ファイル | 医師/技師 | 報告にはDICOM解剖画像を含む |
| 処理後のfMRI画像ファイル | 医師/技師 | 報告にはfMRI賦活マップを二次キャプチャ、DICOMまたはPACSや他の3D表示ソフトウエアに互換性のあるその他のフォーマットで含める |
| Q/A統計結果の要約と問題点 | 医師/技師/研究者 | 報告にはPACSに互換性のある二次キャプチャまたは患者記録シートに添付したできればPACSで表示されるノートを含める |
| 課題遂行行動記録 | 医師/技師/研究者 | 報告にはボタン押しのデータを二次キャプチャまたは患者記録シートに添付したできればPACSで表示されるノートとして含める |
| fMRI課題とそのタイミングの記述 | 医師/技師/研究者 | 報告には患者記録シートに添付したできればPACSで表示されるノートとして含める |
| 検査画像の撮影と後処理の記録シート | 医師/技師 | 報告には患者名、ID、時間、日付、場所、検査者、検査番号、データファイル名とデータの場所、主要なパラメータ条件を含む。検査スタッフによる撮影時に生じた問題を記述したコメントを含める |
解釈を行う医師にとって役立つその他の項目として:(1) 各fMRIスキャンの間の被験者の覚醒状態の自己評価(例えば、1-5のスケール、各スキャンの後で患者に尋ねて取得)、(2) fMRI課題のタイミングと同期させた眼位と瞬きの記録。
4. 評価手続き
このプロファイルに適合するために、担当スタッフおよび設備(“アクター”)はTable 1でそれぞれに割り当てられたアクティビティに携わる。アクティビティに携わるために、アクターはアクティビティサブセクション3の仕様の表に掲げる必要要件(‘shallの言葉遣い’で示されている)を満たさなければならない。セクション3に述べられる多くの必要要件への適合は、単純に直接の観察により評価できる。その他のより定量的な必要要件については、適切な評価手続きが以下の関連するサブセクション(4.1 . 4.4)に述べられている。
各々のアクターが所属する団体による適合の正式な申し立ては、QIBA Conformance Statementの発行により行われる。QIBA Conformance Statementを発行する供給業者は、その製品が適合を達成するためにどのように作られているかを述べた“Device-specific Parameters”(Appendix Eに示す)を提出しなくてはならない。また、供給業者は、適合試験に使用された一連のテストの内容を報告するか、それが入手できるようにしなくてはならない。
また、Conformance Statementを発行するアクターは、適合を証明するのに用いたfMRIデータセットと試験結果の内容を入手可能にするか、全て報告しなくてはならない。適合性の確立には、病変の影響に関連した解釈上の複雑性を避けるため、健康な個人のデータあるいは合成したfMRIデータを用いることが推奨される。
Digital Reference Object(DRO、合成データセット):QIBAは、アクターが後処理や表示ハードウエア・ソフトウエアに関するプロファイルへの適合性を確立することを支援するため、合成されたfMRIデータセットを提供している。これらのデータセットは、QIDWウエブサイトにおいてオンラインで手に入れることができる。これらのデータセットが持つ既知の信号特性(波形、空間分布)は、実施施設または他のアクターによって提供された後処理ハードウエア・ソフトウエアを使って検出された信号と比較することに利用できる。
4.1 評価手続き:MRI装置の仕様と性能
このプロファイルへの適合にはMRI装置の合衆国連邦政府の規制(Delfino, 2015)あるいは米国以外の同様の規制の遵守、American Association of Physicists in Medicine (Jackson et al, 2010)またはAmerican College of Radiology (1)により示されたMRI装置の性能基準および特定のモデルについてスキャナ製造会社が確立した品質管理ベンチマークへの準拠が求められる。これらの評価手続きは資格を持つ医学物理学者やMRI研究者による少なくとも年1回のMRIスキャナの技術的な性能評価を含む。評価されるパラメータには次のものが含まれる:磁場均一性、患者取り扱い器具、傾斜磁場とRFサブシステムの安全性、較正と性能チェック。定期的なMR品質管理では画像の均一性、コントラスト、空間分解能、信号雑音比およびアーチファクトを特定のテスト対象物と手順(例えばACRのファントムとQA手順)を用いて、チェックしなくてはならない。加えて、適切な間隔での予防的な保守が資格を持つサービスエンジニアによって行われ、記録されなければならない。BOLD functional MRIに適したパルスシーケンス(例えばエコープラナーイメージング(EPI))がスキャナで使用できなければならない。
4.2 評価手続き:技師
放射線技師は、ACR MRI Accreditation Program (2)が定める資格を、または米国以外の施設の場合は米国以外の同様の認証プログラムによる資格を満たしていなければならない。これには、American Registry of Radiologic Technologists (ARRT)または同様の米国以外の認定機関による認定、適切なライセンス認可、文書化されたトレーニングおよびMRIの実施経験、そして認定・認可機関の生涯学習の要件への適合が含まれる。技師は、自身の特定のシステムについて、このプロファイルに適合するように、QAとEPIの撮影プロトコルを準備し、実施し、記録できなくてはならない。技師はfMRI検査をスキャナで実施し、患者の行動(コンプライアンス、体の動きなど)がfMRIの質を低下させ得るときは、それを認識できるよう、トレーニングされなければならない。
(2) http://www.acraccreditation.org/~/media/ACRAccreditation/Documents/MRI/Requirements.pdf?la=en
4.3 評価手続き:医師
放射線科医は、ACR MRI Accreditation Program (3)が定める資格を、または米国以外の施設の場合は米国以外の同様の認証プログラムによる資格を満たしていなければならない。これには、American Board of Radiologyまたは同様の米国以外の認定機関による認定、適切なライセンス認可、ABRが求める最低限の数のMRI検査の管理、読影およびレポーティングの文書、そしてABRとライセンス認可委員会の生涯学習の要件への適合が含まれる。fMRIの実施にあたり放射線科医に特に追加の認証が求められることはないが、臨床fMRIの最良の実施法についてよく理解し、それを実践すべきである(4)。American Society of Functional Neuroradiology (ASFNR, https://www.asfnr.org/ )などの職業団体が、トレーニングの機会を提供している。
(3) http://www.acraccreditation.org/~/media/ACRAccreditation/Documents/MRI/Requirements.pdf?la=en
4.4 評価手続き:画像アナリスト
実臨床においては、検査結果を解釈する放射線科医が画像分析を行うことになることが多い。臨床の場面で、あるいは臨床研究において、時として、画像解析を、医学物理学者、生物医学技術者、MRI研究者や3Dラボの技術者など、放射線科医以外の専門家が行うことがある。現在、画像アナリストについて特に認証のガイドラインはないが、放射線科医以外で画像解析を行う者は、fMRIの以下のような技術的側面についてトレーニングを受けなくてはならない:EPI撮影の主要な原理の理解、fMRI関連のDICOMメタデータの内容が、スキャナからPACSや解析ワークステーションまでのネットワークの連鎖に沿って維持されていることを確認する手順。画像アナリストは、EPI時系画像からのfMRI賦活マップの作成や画像アーチファクトの同定を含めた、画像解析ソフトウエアツールの使用と計算に関するエキスパートでなくてはならない。さらに、画像アナリストは、関連するROIを設定し、賦活域を選択するための神経解剖の知識をもっていなくてはならない(上のTable 3.8.2内の図を参照)。
4.5 評価手続き:画像処理および解析ソフトウエア
画像処理および解析のソフトウエアは、臨床的に有用な形で賦活マップを生成するのみならず、検査の技術的な情報(例えば、患者のコンプライアンス、画質など)を要約する。加えて、それらのソフトウエアは、このプロファイルの技術的な要件(下記)への適合を確立するための、特定の評価手続きの実施に役立つものでなければならない。
4.5.1 評価手続き:fMRI重心の再現性(要件)
この手続きは、製造会社または施設が、撮影装置や後処理ソフトウエアのfMRI重心の再現性を評価するのに使われる。fMRI重心の再現性は、平均分散によって評価される。QIBAでは当初、プロファイルの要件を決定するために以下の手続きを採用していた。追加の詳細はAppendix Gを参照。
- 30セット*の日内および日間のtest-retestペアのfMRIデータセットを、Appendix Dで指定された手運動課題を使って取得する。(このプロファイルの要件の決定に使われたデータセットは、Quantitative Imaging Data Warehouse (QIDW)で入手できる)(*根拠についてはAppendix Gを参照)
- その結果得られたデータを適切なソフトウエアで後処理し、fMRI賦活の振幅や正規化したT統計量の大きさを表示する統計学的パラメトリックマップを作成する。
- 有意な反応ボクセルを同定するために適切な統計学的閾値を設定する。
- 中心前回の一次運動野の中、あるいは近傍のfMRI賦活焦点を包含する関心領域(ROI)を設定する。
- おのおののtest-retestペアについて、fMRI賦活焦点内の賦活ボクセルの三次元的位置座標を求める。
- セクション3.9.2で述べた数式を用いて、賦活ボクセルの重みづけ重心を計算する。そして、おのおののtest-retestペアの重心の空間的なずれの分散を計算する。
- 全被験者での平均分散を計算する。結果をプロファイルの要件と比較する。平均分散.4.0であればこの要件に適合する。
4.5.2 評価手続き:Contrast-to-Noise Ratio
fMRIの反応の質は、関心領域内のボクセルのContrast-to-Noise Ratio(CNR)によって評価する。この手続きは、供給業者や撮影施設がfMRIデータセット中の関心の対象となる賦活焦点の(訳注:単語が欠落)を評価するのに利用できる。
評価者は、Table 3.7.2に書かれている運動野皮質の関心領域内の単一の焦点を選択する。
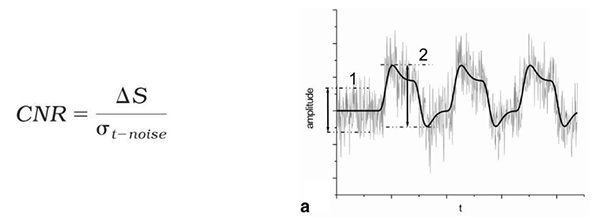
評価者は、Geisslerら(2007)により記載され、Figure 4.2-1に示されている数式を用いて、関心焦点内の全ての閾値上のボクセルのCNRを計算する(例えば、AFNIなどのソフトウエアを用いて)。
ここで、ΔSは真の課題により誘起された信号のpeak-to-peakの振幅の推定値(Fig aの#2)、分子は課題の開始前のスキャンの時間帯あるいは課題関連の信号から回復した後のfMRI信号Sから推定できる、ノイズの時間に関する標準偏差(Fig aの#1)である。
4.5.3 評価手続き:頭部の動き
Table 3.7.2に示された頭部の動きに関する仕様は、“逐次線形重みづけ最小2乗法”アルゴリズムを採用したAFNIの3dvolregルーチンを用いて計算されている。この“逐次線形重みづけ最小2乗法”アルゴリズムでは、時刻tに撮影された画像ボリュームを、ベースの画像ボリューム(通常時刻t=0に撮影される)にできるだけ近づけるような、平行移動と回転の規則を計算する。これがおのおのの連続する時刻について繰り返され、fMRIスキャン中に渡る頭部の動きのベクトルを生成する。同様のベクトルが、3直行軸のそれぞれの方向に沿った平行移動とそれぞれの軸に関する回転について計算される。スキャンの間の三次元的な最大の変位(個々のベクトルから計算される)は、Table 3.7.2で指定された最大の頭部の動き(平行移動または回転)以下でなくてはならない。Table 3.7.2で指定された回転の最大値の要件は、個々の関心焦点での回転の影響はその焦点と回転軸の間の距離に依存するため、おおまかな目安にすぎないことに注意する必要がある。
4.5.4 評価手続き:神経血管脱共役
プロファイルの要件を達成するために、病変とは反対側の一次運動野の賦活から得られるROIを評価し、50%のAMPLE閾値を使って一次賦活クラスターを決定する(両側対称性の賦活を生じる課題を使用:注意事項:1. 患者は課題を適切に遂行している、2. その他のアーチファクトがない、3. 他の影響因子がない)。このクラスターでの最大のT値が、病変側の賦活を評価する閾値を決定する。この最大T値の50%において、病変側に賦活が見られない場合、中等度ないし高度の(すなわち臨床的に影響のある)NVUを意味する。この場合、プロフィル要件は満たされない(Pillai博士の経験的データに基づく)。
その他のアプローチとして、域止め(BH)負荷下での脳血管反応性マッピング(CVR)などの、間接的なNVUの評価法が用いられ得る。この場合、病変反対側の対応する領域に比較し、病変に冒されたまたは直近の皮質におけるCVRの高度の低下ないし消失が、NVUの定性的なサロゲートマーカとみなされるが、上記のより定量的なアプローチが推奨される。
4.5.5 評価手続き:TSNR(仕様Table 3.3.2)
Table 3.3.2に示されたtSNRに関するプロファイルの必要要件を達成するために、以下の数式が用いられる。tSNRは、fMRI時系列全体の信号雑音比の測定量である。時系列xiについて(Murphy Kら、2007)
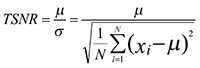
ここで、Nは時点の数、μは時系列の平均、σはその標準偏差である。
5. 参考文献
- American College of Radiology, Magnetic Resonance Imaging QC Manual, 2015.
- Belyaev AS, Peck KK, Brennan NM, Holodny AI. Clinical applications of functional MR imaging. Magn Reson Imaging Clin N Am. May;21(2):269-78. 2013.
- Belaroussi B, Milles J, Carme S, et al. Intensity non-uniformity correction in MRI: Existing methods and their validation. Med Image Anal 10: 234-46, 2006.
- Bosnell, R, Wegner, C, Kincses, ZT, Korteweg, T, Agosta, F, Ciccarelli, O, & Mtthews, PM (2008). Reproducibility of fMRI in the clinical setting: implications for trial designs. Neuroimage, 42(2), 603-610.
- Brown GG, Mathalon DH, Stern H, Ford J, Mueller B, Greve DN, McCarthy G, Voyvodic J, Glover G, Diaz M, Ytter E, Ozyurt IB, Jorgensen KW, Wible CG, Turner JA, Thompson WK, Potkin SG. Multisite reliability of cognitive BOLD data. Neuroimage. 2011;54(3):2163.2175
- Casey, BJ, Cohen, JD, O'Craven, K, Davidson, RJ, Irwin, W, Nelson, CA, & Turski, PA (1998). Reproducibility of fMRI results across four institutions using a spatial working memory task. Neuroimage, 8(3), 249-261.
- Costafreda SG, Brammer MJ, Vencio RZ, Mourao ML, Portela LA, de Castro CC, Giampietro VP, Amaro E., Jr Multisite fMRI reproducibility of a motor task using identical MR systems. J Magn Reason Imaging. 2007;26(4):1122.1126.
- Cox, R. W., & Jesmanowicz, A. (1999). Real-time 3D image registration for functional MRI. Magnetic resonance in medicine, 42(6), 1014-1018.
- Chen JE, Glover GH. Functional Magnetic Resonance Imaging Methods. Neuropsychol Rev. 2015 Sep;25(3):289-313.
- Delfino, JG, U.S. federal safety standards, guidelines and regulations for MRI systems: An overview. Applied Radiology, 2015: p. 20-23.
- Freire, L., & Mangin, J. F. (2001). Motion correction algorithms may create spurious brain activations in the absence of subject motion. NeuroImage, 14(3), 709-722.
- Friedman L, Glover GH. Report on a multicenter fMRI quality assurance protocol. J Magn Reason Imaging. 2006;23(6):827.839.
- Friedman L, Glover GH. Reducing interscanner variability of activation in a multicenter fMRI study: controlling for signal-to-fluctuation-noise-ratio (SFNR) differences. Neuroimage. 2006
- Friedman, L., Stern, H., Brown, G. G., Mathalon, D. H., Turner, J., Glover, G. H. & Potkin, S. G. (2008). Test.retest and between-site reliability in a multicenter fMRI study. Human brain mapping, 29(8), 958-972.
- Friston KJ, Ashburner JT, Kiebel SJ, et al. Statistical Parametric Mapping: The analysis of functional brain images. Elsevier New York. 2007.
- Friston, KJ, Williams, S, Howard, R, Frackowiak, RS, & Turner, R (1996). Movement-related effects in fMRI time-series. Magnetic resonance in medicine, 35(3), 346-355.
- Friston KJ, Holmes AP, Worsley KJ, et al. Statistical parametric maps in functional imaging: a general linear approach. Hum Brain Mapp 2: 189-210, 1995.
- Gabriel M, Brennan NP, Peck KK, Holodny AI. Blood oxygen level dependent functional magnetic resonance imaging for presurgical planning. Neuroimaging Clin N Am. 2014 Nov;24(4):557-71.
- Geissler, A, Gartus A, Foki T, Tahamtan AR, Beisteiner R, Barth, M Contrast-to-noise ratio (CNR) as a quality parameter in fMRI. J Magn Reson Imaging 25(6): 1263-1270, 2007.
- Genovese CR, Lazar NA, Nichols TE. Thresholding of statistical maps in functional neuroimaging using the false discovery rate. NeuroImage 15: 772-86, 2002.
- Glover et al. Function Biomedical Informatics Research Network Recommendations for Prospective Multi-Center Functional Magnetic Resonance Imaging Studies. J Magn Reson Imaging. 2012 Jul; 36(1): 39.54.
- Gorgolewski KJ, Storkey AJ, Bastin ME, et al. Adaptive thresholding for reliable topological inference in single subject fMRI analysis. Frontiers in Human Neuroscience 6: 245, 2012.
- Gountouna VE, Job DE, McIntosh AM, Moorhead TW, Lymer GK, Whalley HC, Hall J, Waiter GD, Brennan D, McGonigle DJ, Ahearn TS, Cavanagh J, Condon B, Hadley DM, Marshall I, Murray AD, Steele JD, Wardlaw JM, Lawrie SM. Functional Magnetic Resonance Imaging (fMRI) reproducibility and variance components across visits and scanning sites with a finger tapping task. Neuroimage.2010;49(1):552.560.
- Greve DN, Mueller BA, Liu T, Turner JA, Voyvodic J, Yetter E, Diaz M, McCarthy G, Wallace S, Roach BJ, Ford JM, Mathalon DH, Calhoun VD, Wible CG, Brown GG, Potkin SG, Glover G. A novel method for quantifying scanner instability in fMRI. Magn Reson Med. 2011;65(4):1053.1061.
- Hoge WS, Pan H,et al, A Method for z-shim Compensated EPI-BOLD Imaging in a Single Shot, in Proc IEEE Intl Symp on Biomedical Imaging (ISBI), 2013, pp. 338-341.
- Hyde JS, Jesmanowicz A. Cross-correlation: an fMRI signal-processing strategy. NeuroImage 15: 848-51, 2012.
- Jackson, EF, et al. Acceptance Testing and Quality Assurance Procedures for Magnetic Resonance Imaging Facilities Report of MR Subcommittee Task Group I. 2010; Available from: http://www.aapm.org/pubs/reports/RPT_100.pdf
- Jenkinson, M, Beckmann, CF, Behrens, TE, Woolrich, MW, & Smith, S M (2012). Fsl. Neuroimage, 62(2), 782-790. Jiang, A., Kennedy, DN, Baker, JR, Weisskoff, RM, Tootell, RB, Woods, RP, & Belliveau, JW (1995). Motion detection and correction in functional MR imaging. Human Brain Mapping, 3(3), 224-235.
- Kwong KK, Belliveau JW, Chesler DA, et al. Dynamic magnetic resonance imaging of human brain activity during primary sensory stimulation. PNAS 89: 5675-5679, 1992.
- Logothetis, NK, Pauls, J, Auguth, M, Trinath, T. Oeltermann, A. (July 2001). A neurophysiological investigation of the basis of the BOLD signal in fMRI. Nature. 412 (6843): 150.157. Our results show unequivocally that a spatially localized increase in the BOLD contrast directly and monotonically reflects an activity.
- Mahdavi A, Azar R, Shoar MH, Hooshmand S, Mahdavi A, Kharrazi HH. Functional MRI in clinical practice: Assessment of language and motor for pre-surgical planning. Neuroradiol J. 2015 Oct;28(5):468-73. 2015.
- Magnotta VA, Friedman L; FIRST BIRN. Measurement of Signal-to-Noise and Contrast-to-Noise in the fBIRN Multicenter Imaging Study. J Digit Imaging. 2006 Jun;19(2):140-7.
- Mazaika PK, Whitfield-Gabrieli S, Reiss A, et al. Artifact repair of fMRI data from High Motion Clinical Subjects increase in neural (with new results from 3-D large motion correction). Annual Meeting of the Organization for Human Brain Mapping. 2007.
- Medina LS, Bernal B, Dunoyer C, Cervantes L, Rodriguez M, Pacheco E, Jayakar P, Morrison G, Ragheb J, Altman NR. Seizure disorders: functional MR imaging for diagnostic evaluation and surgical treatment. prospective study. Radiology. 2005 Jul;236(1):247-53.
- Murphy K, Bodurka K, Bandettini P. How long to scan? The relationship between fMRI temporal signal to noise and necessary scan duration. Neuroimage. 2007 Jan 15; 34(2): 565.574.
- "Magnetic Resonance, a critical peer-reviewed introduction; functional MRI". European Magnetic Resonance Forum. Retrieved 17 November 2014.
- Oakes, TR, Johnstone, T, Walsh, KO, Greischar, LL, Alexander, AL, Fox, AS, & Davidson, RJ. Comparison of fMRI motion correction software tools. Neuroimage 2005; 28(3):529-543.
- Ogawa S, Lee TM, Kay AR, et al. Brain magnetic resonance imaging with contrast dependent on blood oxygenation. PNAS1990; 87: 9868-9872.
- Olsrud J, Nilsson A, Mannfolk P, Waites A, Stahlberg F. A two-compartment gel phantom for optimization and quality assurance in clinical BOLD fMRI. Magn Reson Imaging. 2008;26(2):279.286.
- Petrella JR, Shah LM, Harris KM, Friedman AH, George TM, Sampson JH, Pekala JS, Voyvodic JT. Preoperative functional MR imaging localization of language and motor areas: effect on therapeutic decision making in patients with potentially resectable brain tumors. Radiology. 2006, Sep; 240(3):793-802.
- Pillai JJ, Mikulis DJ. Cerebrovascular reacvity mapping: an evolving standard for clinical functional imaging. AJNR Am J Neuroradiol. 2015 Jan;36(1):7-13.
- Pillai JJ, Zaca D. Clinical utility of cerebrovascular reactivity mapping in patients with low grade gliomas. WJCO 2011; 12: 397-403.
- Pillai JJ, Zaca D. Comparison of BOLD cerebrovascular reactivity mapping and DSC MR perfusion imaging for prediction of neurovascular uncoupling potential in brain tumors. Technol Cancer Res Treat. 2012 Aug; 11(4):361-74.
- Poldrack R, Mumford J, Nichols T. Handbook of Functional MRI Data Analysis. New York: CambridgUniversity Press; 2011
- Raunig DL, McShane LM, Pennello G, Gatsonis C, Carson PL, Voyvodic JT, Wahl RL, Kurland BF, Schwarz AJ, Gonen M, Zahlmann G, Kondratovich MV, O'Donnell K, Petrick N, Cole PE, Garra B, Sullivan DC; QIBA Technical Performance Working Group. Quantitative imaging biomarkers: a review of statistical methods for technical performance assessment. Stat Methods Med Res. 2015 Feb;24(1):27-67.
- Smith, SM, Jenkinson, M, Woolrich, MW, Beckmann, CF, Behrens, TE, Johansen-Berg, H & Matthews, PM (2004). Advances in functional and structural MR image analysis and implementation as FSL. Neuroimage, 23, S208-S219.
- Soltysik DA, Thomasson D, Rajan S, Gonzalez-Castillo J, DiCamillo P, Biassou N. Head-repositioning does not reduce the reproducibility of fMRI activation in a block-design motor task. Neuroimage. 2011 Jun 1;56(3):1329-37.
- Soltysik DA, Hyde JS. Strategies for block-design fMRI experiments during task-related motion of structures of the oral cavity. Neuroimage. 2006 Feb 15;29(4):1260-71.
- Stocker T, Schneider F, Klein M, Habel U, Kellermann T, Zilles K, Shah NJ. Automated quality assurance routines for fMRI data applied to a multicenter study. Hum Brain Mapp. 2005;25(2):237.246.
- Styner M. Parametric estimate of intensity inhomogeneities applied to MRI. IEEE Trans Med Imag 2000; 19: 153-65.
- Thulborn KR, Waterton JC, Matthews PM, et al. Oxygenation dependence of the transverse relaxation time of water protons in whole blood at high field. Biochem Biophys Acta 714: 265-270, 1982.
- Ulmer JL, Hacein-Bey L, Mathews VP, Mueller WM, DeYoe EA, Prost RW, Meyer GA, Krouwer HG, Schmainda KM. Lesion-induced pseudo-dominance at functional magnetic resonance imaging: implications for preoperative assessments. Neurosurgery. 2004 Sep;55(3):569-79;
- Voyvodic, JT. Reproducibility of Single-Shot fMRI Language Mapping with AMPLE Normalization. JMRI 36: 569-580, 2012.
- Voyvodic JT, Petrella JR, Friedman AH. fMRI activation mapping as a percentage of local excitation: consistent presurgical motor maps without threshold adjustment. J Magn Reson Imaging. 2009 Apr;29(4):751-9.
- Vlieger, E. J., Lavini, C., Majoie, C. B., & den Heeten, G. J. (2003). Reproducibility of functional MR imaging results using two different MR systems. American journal of neuroradiology, 24(4), 652-657.
- Wengenroth M, Blatow M, Guenther J, Akbar M, Tronnier VM, Stippich C. Diagnostic benefits of presurgical fMRI in patients with brain tumours in the primary sensorimotor cortex. Eur Radiol. 2011 Jul;21(7):1517-25. Epub 2011.
- Woolrich MW, Behrens TEJ, Beckmann CF, et al. Mixture models with adaptive spatial regularization for segmentation with an application to fMRI data. IEEE Trans Med Imag 24: 1-11, 2005.
- Wurnig, MC, Rath, J, Klinger, N, Hollinger, I, Geissler, A, Fischmeister, FP, & Beisteiner, R (2013). Variability of clinical functional MR imaging results: a multicenter study. Radiology, 268(2), 521-531.
- Zou, KH, Greve, DN, Wang, M, Pieper, S D., Warfield, SK, White, NS, & Wells III, WM (2005). Reproducibility of Functional MR Imaging: Preliminary Results of Prospective Multi-Institutional Study Performed by Biomedical Informatics Research Network 1. Radiology, 237(3), 781-789.
6. Appendices
Appendix A:謝辞と帰属
この画像プロトコルは、Radiological Society of North America (RSNA) Quantitative Imaging Biomarker Alliance(QIBA)Functional MRI (fMRI) Technical Committeeにより提供される。fMRI Technical committeeは画像装置製造会社、画像解析ソフトウエア開発者、画像解析研究所、バイオ薬品会社、アカデミア、政府系研究機関、職能団体、規制当局、その他に所属する研究者により、構成される。全ての成果は、基礎研究段階のものとして取り扱われる。fMRIグループとその研究についてのより詳細な記述は、次のウェブリンクで閲覧できる:http://qibawiki.rsna.org/index.php?title=FMRI_tech_ctte
fMRI Technical Committee(アルファベット順)
Andrew J. Kalnin, MD, Bradley A. Jabour, MD, Cathy Elsinger, PhD (past co-chair), Dariya Malyarenko, PhD, David Soltysik, PhD, Daniel Sullivan, MD, Edward Jackson, PhD, Feroze Mohamed, PhD, Gudrun Zahlmann, PhD, Gary Gong, MD, PhD, Jeffrey Petrella, MD (past co-chair), James L. Reuss, PhD (co-chair), Jedidiah (Jed) Mathis, Jay J. Pillai, MD (co-chair), James T. Voyvodic, PhD, Kirk M. Welker, MD, Nancy Obuchowski, PhD, Thomas Chenevert, PhD, Ted DeYoe, PhD (co-chair), Yuxiang Zhou, PhD, DABR, Zhiyue Jerry Wang, PhD, Haris Sair, MD.
fMRI Technical CommitteeはRadiological Society of North Americaのスタッフの支援と技術的なサポートに深く感謝する。
Appendix B:コンベンションと定義
撮影・解析・解釈とは:この文書は、データを情報に、そして知識に変化させていく流れのステップを、撮影、再構成、後処理、解析および解釈にまとめている。撮影、再構成、後処理は、被験者からの新たなデータの収集と構造化に関わる。解析は一次的に、データを情報に変換し重要な価値を取り出す、計算過程と考えられる。解釈は基本的に、情報を知識に変換する判断と考えられる。(知識の知恵への変換は、この文書の範囲を超える)
ブルズアイ適合レベル 撮影パラメータ値やその他、このプロトコルの要件は、“ブルズアイ”アプローチを用いて指定されている。最も広いものから最も狭いものまで、以下のように意味づけされる3つの輪が想定されている:
許容可能:この仕様を満たさない場合、データはこのプロトコルの想定される用途には許容できないものになる可能性が大きい。
目標:この仕様への適合は妥当な努力と装備で達成可能であり、許容可能仕様に適合する場合より良好な結果をもたらすことが期待される。
理想的:この仕様への適合は並外れた努力と装備が必要であるが、目標仕様に適合する場合より、良好な結果をもたらすことが期待される。
各パラメータについて、許容可能レベルの仕様は常に与えられている。よりよい結果(例えば、より高い画質、より高い再現性、より少ない被ばく線量など)が期待されない場合、目標および理想的の仕様は書かれていない。
いくつかのプロトコルでは、それが一貫してより高い適合レベルで実施されることを求めており、その場合、施設はその“適合レベル”を宣言することを要求されることがある。もし、ある施設が目標レベルで運用すると宣言すると、その施設は、目標レベルの仕様が与えられている場合は常に目標レベルを達成しなければならず、目標レベルの仕様がない場合は、許容可能レベルを達成しなければならない。同様に、施設が理想的レベルを宣言すると、その施設は、理想的レベルの仕様が与えられている場合は常に理想的レベルを達成しなければならず、理想的レベルの仕様がない場合は、目標可能レベルを、目標レベルがなければ、許容可能レベルを達成しなければならない。
Appendix C:パラダイムの仕様-手運動課題
fMRIパラダイムがBOLD信号変化を生じる能力は、fMRIスキャンの間に患者が遂行する行動課題の選択とデザインに強く依存する。課題は、機能的に特異的で明瞭なfMRI賦活を生じさせるように十分に困難でなくてはならないが、適切な実施を妨げたり、課題と相関する頭部の動きが生じたりするほど困難すぎてはならない。下の表は、手の運動に関連する脳領域をマップするのに適した、両手運動課題の手順を示している。しかし、一見して小さな課題のデザインや実施法の変化でも、fMRIの結果に影響し得ることを心に留めておくことは重要である。例えば、課題を指と親指の対向運動から、指同時屈曲運動に変えると、賦活マップの重心に影響を与えうる。一般的には、要件を決定するのに使用した値よりも、臨床的に許容可能な値の範囲は広いことが多い。
行動課題パラダイムの記述
| パラダイム | 適合レベルを達成するためのパラメータ設定 | |
|---|---|---|
| 手運動 (ASFNRの手順) |
エポック0(解析から除外) | 運動なし |
| エポック0継続時間 | 6-8秒 | |
| エポック1課題 | 自己ペース、掌握、左手 | |
| エポック1継続時間 | 9-15秒(要件で使用)、20秒(推奨) | |
| エポック2課題 | 自己ペース、掌握、右手 | |
| エポック2継続時間 | 9-20秒 | |
| エポック3課題 | 運動なし | |
| エポック3継続時間 | 9-20秒 | |
| 反復回数 | 4(エポック1,2,3の順で反復) | |
Appendix D:要件に適合するための撮影装置のパラメータ
MRスキャナにおけるばらつきは、fMRIの結果に影響し得る。面内やスライス方向の分解能の増減、レシーバーバンド幅の選択、RFコイルのタイプ、エコー時間の最適化などは全て、BOLD信号の信号およびノイズ特性に影響し得る。再現性のよい結果を得るためには、固定したパラメータの設定を用いて、患者間の違いに対応するための変更(例えば、field of view、スライス数、スライス位置)を最小限に留めることが望ましい。
注意:スキャナの製造会社とモデル:このプロファイルは、臨床用MRIスキャナで行ったtest-retest再現性試験に基づいている。SiemensとGEのスキャナが使われ、1.5Tと3.0Tの間でデータを比較した。データは全て8チャンネル受信専用頭部用コイルを使って得た。以下のデータにおいて特定の製品モデル/バージョンの使用は、それらの製品がこのQIBAプロファイルに完全に適合していることを意味すると受け取られるべきではない。同様に、その他のハードウエアやソフトウエアのモデルが含まれていないことは、それらがプロファイルに適合しないことを意味しない。ここで示した以外の装置の使用については、この文書作成の時点で未確認である(スキャナ製造会社や後処理ソフトウエア会社から適合の声明が追って発行されることになる)。
MR撮影パラメータ
| 記述 | 要件を満たすためにQIBA再現性試験で使われたパラメータ設定 | |
|---|---|---|
| 画像撮影パラメータ | 磁場強度 | 1.5Tと3.0T |
| スキャンタイプ | BOLD T2*強調グラディエントエコー、エコープラナー | |
| Field of view (FOV) | 240 mm | |
| スライス厚 | 3 - 5 mm | |
| スライス数 | 20 - 36 | |
| 繰り返し時間(TR) | 1.5 . 3 sec | |
| エコー時間(TE) | 3Tで30-35 ms、1.5Tで40-50 ms | |
| 繰り返し数(TR時間数) | 90 - 256 | |
| フリップ角 | 90 | |
| NEX | 1 | |
| パラレルイメージングファクタ | 使用せず | |
Appendix E:fMRIの処理
以下の表中の値は、このプロファイルの要件を決定するために使われたQIBAが支援した研究の中で行われた処理のステップを反映している。この中のあるものは、各ステップの要件の再現性への影響を検証するために、異なる解析の中で、使用されたりされなかったりした。
| 処理ステップ | 要件に適合するための設定 | |
|---|---|---|
| データの統合 | 使用 | DICOM画像を4Dボリュームデータセットに統合(例えばAFNI BRIKやNIFTIフォーマット) |
| fMRI画像と構造画像のコレジストレーション | 使用 | AFNIまたはfScan(Voyvodicら、2009を参照) |
| 最初の過渡的データの削除 | 使用 | 最初の3-12秒を削除 |
| 動き補正 | 使用 | 全ての時系列画像を基準時点の画像にそろえる |
| 空間的平滑化 | 使用 | 4-6 mm |
| ゼロ平均補正、トレンド除去 | 使用 | 直線または低周波トレンド除去 |
| 正規化(例えばAMPLE) | 不使用 | (正規化のありなしの比較の検討において) |
| 使用 | 賦活域内の平滑化後のfMRIピーク振幅でボクセル値を割り算 | |
| 課題関連のfMRI信号の検出と測定 | 使用 | tテストまたは一般線形モデル(GLM) |
| 閾値処理 | 使用 | t統計量カットオフ3,4,6,8,10;AMPLE閾値カットオフ40%,60%,80%で検討 |
Appendix F:賦活ボクセル同定のための閾値基準の選択
fMRI賦活焦点を成すボクセルのcontrast-to-noise ratio(CNR)は通常、重みづけ重心(wCM)の近傍で最も大きく、離れるにつれて減少していく。その結果、賦活焦点の辺縁部のボクセルでの信号はfMRIノイズよりわずか部分的に大きい程度となる。したがって、wCMの計算では、“賦活して”おり、賦活焦点の一部と考えられるボクセルを同定するための統計学的な閾値基準を選択する必要がある。もし、wCMの周囲のCNR値の空間分布が完全に対称であれば、閾値が大きく変化してもwCMの計算への影響は少ない。しかし、これは実際にはめったにないことであり、したがって、wCMの測定における閾値に依存する変動を低減するためには、一貫した閾値基準を選択することが望ましい。残念ながら、fMRI課題による反応の振幅に基づいた固定した従来のT統計量を使うと、それでもなお、特にMRIスキャンセッション間や患者間で、fMRI賦活焦点の範囲、形、wCMに容認できない大きな変動を生じる。このような変動を減じるための1つの方法は、AMPLE(Voyvodic JT, 2009)などのアルゴリズムを用いて、fMRI反応の振幅を正規化することである。この方法は、固定した閾値基準を用いた場合に比べ、fMRI賦活焦点を大きさや形、wCMに関してより一貫性の高いものにすることに役立つ。機能に特異的なニューロンの位置のバイオマーカとしてのfMRIの正確性を最大限に高める広く認められた閾値基準は、未だに確立していないが、関連するデータについて、Voyvodicら、2009を参照。
Appendix G:重みづけ重心の推定とその精度(変動性)
fMRI焦点の重みづけ重心の位置座標の計算式は上記セクション3.9.2で示されている。以下の式は、M反復測定に基づく、撮影セッション内または間でのwCMの精度/変動性を推定するために使用された。入力データは、個々の反復測定のそれぞれの平均重心座標Xj Yj Zj(M fMRIイメージングセッションのそれぞれで得られた)である。
セッション内変動-M回のセッション内反復測定[Xi Yi Zi]
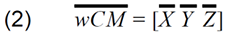 セッション内の総平均座標
セッション内の総平均座標
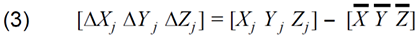 セッション内平均との差
セッション内平均との差
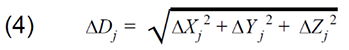 セッション内平均からの距離
セッション内平均からの距離
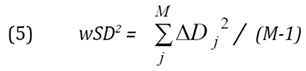 セッション内分散
セッション内分散
セッション間変動-MをL=セッション数で置き換える以外は上に同じ
(それぞれのセッション内反復および患者についてセッション間の測定がある)
サンプルサイズ-アクターたちのセッション内標準偏差(wSD)の評価(要件が基礎にしているwSDが2.55以下であることを担保するための)において、アクターたちは30人の被験者を用いてtest-retest試験を行わなければならない。そして、wSDを計算しなくてはならない。もし、wSDが2.0以下であれば、要件を満たしている。2.0というのが、アクターが(サンプル数N=30で)そのwSDが要件を満たすことを95%信頼できるために許容できる最大のwSDである。
Appendix H:fMRIの変動の原因としての頭部の動き
fMRIスキャンの間の頭部の動きは、信号の変動とその結果としてのfMRIデータから得られる定量的測定量の不正確性の最も重要な原因の1つである(Friston, K.J., et al., 1996, Wu, D.H., et al 1997, Oakes, T.R., et al., 2005, Johnstone, T., et al., 2006, Hutton, C., et al., 2011)。このプロファイルの条件の中で、頭部の動きは、fMRI焦点の重心の変動に寄与し、極端な場合、重心に関するプロファイルの要件を達成できなくする。したがって、fMRIスキャン中の被験者の頭部の動きのリアルタイムまたは撮影後の評価が、強く推奨される。撮影後の計算アルゴリズムは、頭部に動きの悪影響を低減するのにある程度役立つ。しかし、頭部の動きの大きさや性質によっては、完全な補償/補正は不可能なことがある。したがって、唯一の確実な対処法は、頭部の固定の改善後のfMRIデータの再撮影であろう。
頭部の動きの性質と効果:頭部の動きの性質は、MRIスキャンセッション中、セッション間、または患者間で時間とともに大きく変化し得る。動きはゆっくりしたドリフトや回転、呼吸や課題遂行に相関した周期的な運動、または被験者がうとうとした後に覚醒したときに生じる短い急な動きとして見られる。ある被験者、特に小児では、長時間完全にじっとしていることがむずかしいことがあるし、体の痛みを持つ患者では不快になると動くことがある。
頭部の動きは、BOLD fMRIの信号にさまざまな形で影響し得る。固定されたボクセルのマトリックスに対して頭部が動くことで、特に脳や脳室の端などの組織の境界に位置している場合、ボクセルの内容が変化する。さらに、fMRIパルスシーケンス(例えばエコープラナーなど)によって、脳の異なる“スライス”が、わずかに異なる時刻に撮影され、頭部の動きの影響は、時間と空間の両者の相互作用を反映する。動きの空間的・時間的パタンが分かっていて、ある脳部位が経時的に占めるボクセルの瞬間瞬間の信号を継ぎ足すことで信号を再構築すれば、賦活されたfMRIの脳部位からの信号を再現することができると考えるかもしれない。しかし、部分容積効果や非線形の変形、磁化率アーチファクト(Wu, D.H. et al 1997)、さらにあるボクセルを占めるスピンの“歴史”(Friston, K.J. et al., 1996)のため、そのような再現はせいぜい部分的にしかうまくいかない(Oakes, T.R., et al.,2005, Siegel, J.S., et al., 2014)。
fMRIスキャンの間の行動課題の遂行に同期した頭部の動きは、動きの影響が課題に誘発された真のfMRI信号のタイミングに類似するため、特にやっかいである。したがって、動きによる影響は、課題に誘発された賦活と区別することがほとんど不可能な場合がある。例えば、つま先屈曲運動を休止と交互に繰り返し行う課題は、運動野の足の支配域を賦活するためによく用いられる課題である。しかし、運動があまりに熱心に行われると、動きが体に沿って頭部まで伝達され、モーションアーチファクトを生じる。fMRI信号の時間変化と画像の変化を視覚的に確認することで、しばしば、そのような影響を見つけることができる。後処理の後、課題に相関する頭部の動きは、脳の輪郭に沿った明瞭な“fMRIハロ”として認められることがある。その他の部位では、そのような“偽陽性fMRI”反応は見つけることがよりむずかしく、真の課題誘発の反応を含んだボクセルと入り混じって、賦活部位のサイズや重心を歪め得る。fMRI課題と相関しない頭部の動きは、真のfMRI反応の検出感度を低下させ、課題に相関する動きは、真の賦活焦点を拡大させたり偏位させたりする、余分な“偽陽性”を生じる。
許容可能な頭部の動きの範囲:被験者が完全に動かないでいることはほぼ不可能であり、呼吸や心拍でさえfMRIスキャンに影響し得る。そこで、我々はTable 3.7.2に許容可能なレベルの頭部の動きのガイドラインを示してみた。この基準は厳密なものではなく、また、影響の深刻さは偽の信号と真のfMRI信号の相対的な位置や、関心の反応の測定量(例えば、振幅かサイズか重心か、など)に強く依存することを、強調しておく。表3.7.2の基準は、QIBA fMRI委員会のメンバーによるシミュレーション(下に簡単に述べる)とfMRI実施者の十分な実務経験による推定値である。
頭部の動きの低減:成功するfMRI検査では通常、頭部の動きの影響を低減する戦略が取り入れられている。ここで、我々の経験に基づくアドバイスを記すが、これらの手法の大部分は常識であるか、経験から生まれたものである。第一に、セットアップ作業を円滑にするために、頭部の動きの問題を、スキャナに入る前に被験者と話し合い、質問の機会を与えることは役に立つ。施設によっては、被験者がスキャナボアの中に仰臥位で横になり、パッドを配置して快適な体位を保持することに慣れ、必要な行動課題を遂行する間、頭部を動かないようにする練習を行うために“模擬”のスキャナを使用している。MRIスキャナへのネガティブな感情的反応はスキャン中の頭部の動きを増加させることがあるため、この時点において、閉所恐怖やその他の感情的な反応への敏感さをスクリーニングすることは有益である。咳やくしゃみ、鼻閉/鼻水、排せつ行為への対応も必要である。被験者をスキャナに寝かせ、パッドや支持器具を配置する作業は、被験者がリラックスするにつれパッドにゆっくりと沈んで行くようなことのない、快適で固定された体位をとるために、練習を要する。被験者に、“体中の全ての部位の筋を弛緩させ完全にリラックスする”ように指示することは、とりわけ有用である。患者に頭部をそのまま硬く保持しようとせず、むしろ全ての筋を“やわらかく”させるように強調すべきである。パッドを膝下や頭部の両側に入れるべきである。もっも頻度の高いアーチファクトの原因となる頭部の“うなずき”動きを抑制するために、パッド(例えばまるめたタオルなど)を首の下に置いたり、樹脂フォームを頭の上や背側に入れることは重要である。特に頭の背側など、圧がかかりやすい点には十分パッドを入れるべきである。固い表面を足が押す企図しない動きは頭部に容易に伝達されるため、通常、足は固定せずに安静にして、足底がしっかりした支持台を押すような状態にはすべきでない。被験者には行動反応ボタンを与え、スキャン中を通じて維持可能な、快適な手の位置を探すように指示するべきである。セッションの中で、複数のスキャンが予定されていて、慎重な位置合わせが重要な場合は、被験者にはスキャナが稼働していない間も動かずにいるように指示する。MRI施設に設置されたハードウエアとソフトウエアによっては、撮影中に頭部の動きの信号をモニタし、許容できない動きが見られたときは被験者にフィードバックすることもできる。被験者に操作者が頭部の動きをモニタできることを知らせることが、時として、“不注意な”動きへの抑止力になる。
頭部の動きの補正:撮影中の頭部の動きを低減する最大限の努力を払っても、それでもなお、そのような動きがデータに悪影響を及ぼすことがある。さまざまな技術やアルゴリズムが、頭部の動きの悪影響を低減するために用いられる(Friston, K.J., et al., 1996, Oakes, T.R., et al.,2005, Siegel, 2014, Bullmore, E.T., et al., 1999, Glover, G.H., 2000, Birn, R.M., 2004, Diedrichsen, J. Neuroimage, 2005, Birn, R.M., et al., 2006, Lemieux, L., et al., 2007, Huang, J., et al 2008. Churchill, N.W., et al., 2012)が、あらゆるケースに有効なものはない。さまざまなソフトウエアパッケージが、fMRIの解析結果に関するかぎりほぼ等価なアルゴリズムを提供している(Oakes, T.R., et al.,2005, Morgan, V.L., et al.,2007)。fMRI信号の手作業による視覚的な評価が推奨され、理想的には撮影中に、あるいは少なくとも後処理の第一段階として行うべきである。瞬間的な(スパイク様の)動きを検出でき、相対的に低頻度であれば、それを用手的に“打ち切り”(除去/置換)することができる。頭部の動きのゆっくりした“ドリフト”様の変化は、計算により時系列データの平均や低次(典型的には1から3次)のトレンド除去により低減できる。頭部の三次元方向の位置と回転の独立した推定値が利用できれば(AFNI、AIR、Brain Voyager、FSL、SPM2(Oakes, T.R., et al.,2005)など、多くのソフトウエアパッケージで得られる)、それらにより生じる信号が、回帰法により記録から除去できる(Friston, K.J., et al., 1996, Morgan, V.L., et al.,2007)。しかし、頭部の動きがfMRI課題と時間的に相関していると、予想される頭部の動きの“回帰による除去”は、同時に真のfMRI信号も除去してしまう。もし動きが課題に相関していなければ、課題タイミングの波形との時間的相関などのfMRI反応の検出法は、ランダムな頭部の動きの比影響を較的受けにくい。
頭部の動きの影響のシミュレーション:頭部の動きの真のfMRI賦活への影響の定量的実験的な評価は、賦活の真のパタンが独立して分かっていないため、難しい。その点、シミュレーションの利用は、fMRI賦活のパタンやのノイズの性質を正確にコントロールでき、指定できるため、有益である。しかし、シミュレーションが実際の被験者から得られる信号とノイズの性質をどの程度正確に模倣するかは、その解釈上の重要な懸念事項である。QIBA fMRI委員会は頭部の動きに関して多くのシミュレーション研究を行っている。これらの研究の詳細な説明は発表された科学論文に示されるが、簡単な要旨を一部ここに記す。
- 課題に相関した動きは、真の賦活焦点を再現する可能性を大きく損ない、プロファイルの要件を無効にすることもある。
- 頭部の動きは、動き/回転の軸の間で大きく異なることがある。
- 頭部の動きの影響は脳全体で均一ではなく、組織の急激な境界(例えば脳室の縁など)で特に著明になることがある。
- 頭部の動きが脳内の関心領域に与える影響は、その領域の上記の因子(#2,3)との相対的なサイズ、形、向きなどに依存することが多い。どのタイプの動きが最も大きな影響をもたらすかを明らかにし、その他もう少し詳細を手短かに付け加える。
頭部の動きの評価法の改善:fMRIにおける従来の頭部の動きの評価法は、動き補正アルゴリズムにより得られるスキャンとスキャンの間の平行移動と回転の測定に基づく(Cox & Jesmanowicz, 1999)。これにより、動きのパラメータの時系列での累積の平行移動と回転の最大値が計算される。動きの閾値として、最大の累積平行移動の上限を1または2mm、そして最大累積回転の上限を1または2度に設定することが多かった。しかし、これらの上限の値の妥当性は、実験的に検証されたことはない。また、これらの上限は、関心ボクセルへの回転の複雑な影響のために疑わしいものである。数学的には、回転による偏位は回転角度θと回転軸から関心領域までの距離dにより計算できる:
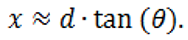
回転軸が関心領域に近接している場合では、回転による移動は小さくなる。逆に、回転軸が関心領域から大きく離れている場合は、同じ回転角度でも変位は大きくなる。したがって、異なるタイプの回転(すなわちピッチ、ヨー、ロール)に対して同じ回転の上限を設定することは賢明ではない。ピッチとヨーは一次運動野からは遠く離れている頸部での回転軸に関する回転であり、一方ロールは運動野から近い上下軸に関する回転と定義される。このため、ピッチとヨーの回転では、同じ大きさのロールの回転よりも、運動野に大きな変位を生じる。
回転軸から関心領域までの距離を計算するために、各回転軸と関心領域(例えば一次運動野など)の中心の座標を取得する必要がある。例としてピッチでは、回転軸のyおよびz座標(yi, zi)と一次運動野の中心のyおよびz座標(yj, zj)を取得する必要がある。ピッチでは脳はx軸に関して回転するため、x座標は無視できる。2つのポイントの距離は以下のように計算される:
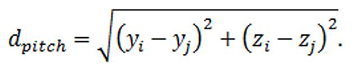
ロールについての距離はxおよびy座標、ヨーのついての距離はx座標とz座標を使って計算される。Talairachアトラスを用いた回転による変位の計算例をTable 1に示す。明らかに、1°のピッチやヨーは、1°のロールよりもずっと大きな悪影響を及ぼしている。
Table 1. 回転と回転による変位の計算結果の例
| 回転 | 回転軸とM1の中心との推定距離 | 回転による変位 | |
|---|---|---|---|
| ピッチ | 1° | 114mm | 2.0mm |
| ヨー | 1° | 118mm | 2.1mm |
| ロール | 1° | 32mm | 0.6mm |
これを踏まえて、平行移動と回転の両者を考慮した頭部の動きの新たな指標が考案された(Soltysik, 2017)。頭部の動きの第1の指標はsample standard deviation of motion root mean squareと呼ばれる:
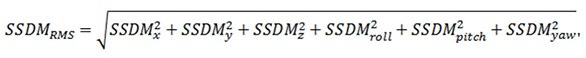
これは、動きの6サンプル標準偏差の二乗平均平方根である:

それぞれの項は、動きのパラメータ時系列のN値を使って計算される。回転についてのSSDM式では、回転による変位を計算するために、回転軸と関心領域の距離(d)を用いていることに注意。頭部の動きの指標SSDMrmsは、頭部の動きのボリューム間の全ての移動の6つの自由度についての二乗和の標準偏差と考えることができる。
頭部の動きの第2の指標はmaximum cumulative motion root mean squareである:
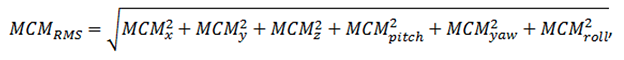
これは、累積の動きの6つの最大値の二乗平均平方根である:
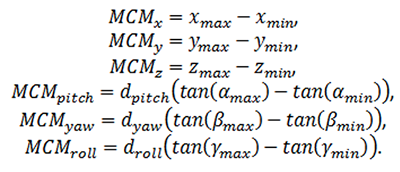
ここでも、回転についてのMCM式は、回転による変位を計算するために、回転軸と関心領域の間の距離を用いている。頭部の動きの指標MCMrmsは、変位の最大値の6つの自由度についての二乗和と考えることができる。
頭部の動きの評価のためのDRO研究
SSDMrms、MCMrmsおよび賦活域の真の重心の間の関係を評価するためにdigital reference object(DRO)を使ったシミュレーションが行われた(Soltysik, 2017)。最悪の状況として、運動皮質にスライス内で0から0.5mmの動き(x、yおよびロールによる変位)とスライス外方向に0から4mmの動き(z、ピッチによる変位およびヨーによる変位)を生じるランダムな頭部の動きを加えた。DROは空間分解能4×4×4 mm3、TR2秒を設定した。その結果、SSDMrmsとMCMrmsの両者について、値が小さい間は、真の重心からの偏位は急速に増加し、その後プラトーになることが分かった(Fig. 1)。SSDMrmsが1.4mm未満、MCMrmsが3.5mm未満では、真の重心からの偏位は95%のケースで8mm以下であった。非常に少数の例のみで、偏位がFig. 1での破線のレベルを超えていることに注意。
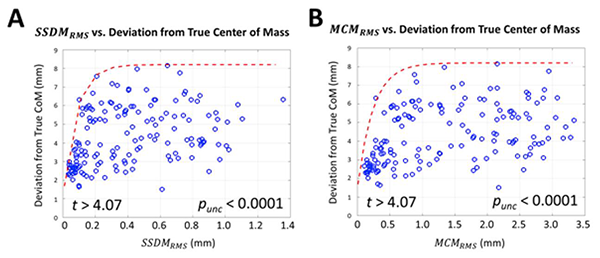
Figure 1. 2つの異なる頭部の動きの指標に対しする真の重心からの偏位のプロット。A). B). 破線は95%のケースでの見込まれる最大の偏位を示す。
このシミュレーションの結果は、賦活域の体積と異なり、運動皮質賦活域の重心は、fMRI
検査でよく見られる程度以上のものであっても、頭部の動きに対して非常に安定であるということを示した。同時に、Fig. 1によると、真の重心からの偏位を低減させる唯一の方策は、頭部を完全に固定することである。しかし、この目標は、バイトバーを使用しても非現実的である(Diedrichsen, 2005)。したがって、SSDMrmsが1.4mm未満、MCMrmsが3.5mm未満の範囲内では、DRO研究は、真の重心からの偏位は8mmの一定した値以内であることを示している。この値は、我々の実験での結果から導かれた、現在のプロファイルの要件である5mm以内よりもやや大きい。この乖離の原因として、DRO研究では頭部の動きの影響が少し過大評価されている可能性が挙げられる。しかし、数学的には、DRO研究は、SSDMrmsが最大1.4mm、MCMrmsが最大3.5mmという広い範囲の頭部の動きについて、見込まれる偏位の最大値はほぼ同じ程度ということを明らかにした。したがって、以前の研究で課されていた、最大の動きを1ないし2mm以内にするというような過剰な制限は不必要である。
DRO研究の結果に基づき、また、保守的な許容誤差を含めて、頭部の動きの指標に関して以下のQAの推奨を提言する:QIBA fMRIプロファイル要件が達成されることを保証するためには、SSDMrmsは1.0mm未満かつMCMrmsは3.0mm未満でなくてはならない。
Appendixの参考文献
- Birn, R.M., et al., Separating respiratory-variation-related fluctuations from neuronal-activity-related fluctuations in fMRI. Neuroimage, 2006. 31 (4): p. 1536-48.
- Birn, R.M., R.W. Cox, and P.A. Bandettini, Experimental designs and processing strategies for fMRI studies involving overt verbal responses. Neuroimage, 2004. 23 (3): p. 1046-58.
- Bullmore, E.T., et al., Methods for diagnosis and treatment of stimulus-correlated motion in generic brain activation studies using fMRI. Hum Brain Mapp, 1999. 7 (1): p. 38-48.
- Churchill, N.W., et al., Optimizing preprocessing and analysis pipelines for single-subject fMRI. I. Standard temporal motion and physiological noise correction methods. Hum Brain Mapp, 2012. 33 (3): p. 609-27.
- Cox RW, Jesmanowicz A. Real-time 3D image registration for functional MRI. Magnetic resonance in medicine. 1999; 42: 1014-8.
- Diedrichsen, J. and R. Shadmehr, Detecting and adjusting for artifacts in fMRI time series data. Neuroimage, 2005. 27 (3): p. 624-34.
- Field A., et al. False Cerebral Activation on BOLD Functional MR Images: Study of Low-amplitude Motion Weakly Correlated to Stimulus . Am J Neuroradiol, 2000. 21 :1388.1396.
- Friston, K.J., et al., Movement-related effects in fMRI time-series. Magn Reson Med, 1996. 35 (3): p. 346-55
- Glover, G.H., T.Q. Li, and D. Ress, Image-based method for retrospective correction of physiological motion effects in fMRI: RETROICOR. Magn Reson Med, 2000. 44 (1): p. 162-7.
- Hutton, C., et al., The impact of physiological noise correction on fMRI at 7 T. Neuroimage, 2011. 57 (1): p. 101-12.
- Huang, J., A.P. Francis, and T.H. Carr, Studying overt word reading and speech production with event-related fMRI: a method for detecting, assessing, and correcting articulation-induced signal changes and for measuring onset time and duration of articulation. Brain Lang, 2008. 104 (1): p. 10-23.
- Johnstone, T., et al., Motion correction and the use of motion covariates in multiple-subject fMRI analysis. Hum Brain Mapp, 2006. 27 (10): p. 779-88.
- Lemieux, L., et al., Modelling large motion events in fMRI studies of patients with epilepsy. Magn Reason Imaging, 2007. 25 (6): p. 894-901.
- Morgan, V.L., et al., Comparison of fMRI statistical software packages and strategies for analysis of images containing random and stimulus-correlated motion. Comput Med Imaging Graph, 2007. 31 (6): p. 436-46.
- Oakes, T.R., et al., Comparison of fMRI motion correction software tools. Neuroimage, 2005. 28 (3): p. 529-43.
- Siegel, J.S., et al., Statistical improvements in functional magnetic resonance imaging analyses produced by censoring high-motion data points. Hum Brain Mapp, 2014. 35 (5): p. 1981-96.
- Soltysik DA. Simulating the effect of head motion in fMRI. Proceedings of the 23rd Annual Meeting of the Organization of Human Brain Mapping, Vancouver, Canada, June 2017.
- Voyvodic JT, Petrella JR, Friedman AH. fMRI activation mapping as a percentage of local excitation: consistent presurgical motor maps without threshold adjustment. J Magn Reson Imaging. 2009 Apr;29(4):751-9.
- Wu, D.H., J.S. Lewin, and J.L. Duerk, Inadequacy of motion correction algorithms in functional MRI: role of susceptibility-induced artifacts. J Magn Reson Imaging, 1997. 7 (2): p. 365-70.